РД 34.37.509-83 (1996)
РУКОВОДЯЩИЙ ДОКУМЕНТ
МЕТОДИКА ОПРЕДЕЛЕНИЯ УГЛЕКИСЛОТЫ В РАСТВОРАХ АММИАКА
РД 34.37.509-83
Дата введения 1984-07-01
РАЗРАБОТАН Всероссийским теплотехническим научно-исследовательским институтом (ВТИ)
ИСПОЛНИТЕЛИ Ю.М. Кострикин, Н.М. Калинина, С.М. Рубчинская, О.М. Штерн, С.Ю. Петрова
УТВЕРЖДЕН Главным техническим управлением по эксплуатации энергосистем 26.12.83
Главный инженер В.В. Нечаев
ПЕРЕИЗДАНИЕ с Изменением № 1 в 1996 г.
Настоящий Руководящий документ распространяется на растворы аммиака, применяемые для поддержания pН питательной воды котлов тепловых электростанций, и устанавливает методы определения содержания связанной углекислоты в растворах.
1 АППАРАТУРА И РЕАКТИВЫ
Кальций хлористый - по ТУ 6-09-4711;
кислота соляная - по ГОСТ 3118 или фиксанал по ТУ 6-09-2540;
кислота серная - по ГОСТ 4204;
натрия гидрооксид - по ГОСТ 4328;
магний сернокислый фиксанал - по ТУ 6-09-2540;
трилон Б - по ГОСТ 10652;
спирт этиловый ректифицированный технический - по ГОСТ 18300;
эриохром черный Т - по ТУ 6-09-4772;
метиловый оранжевый - по ТУ 6-09-4530;
бария гидроокись восьмиводная - по ГОСТ 4107;
фенолфталеин - по ТУ 6-09-5360;
аммиак водный - по ГОСТ 3760;
аммоний хлористый - по ГОСТ 3773;
кислота щавелевая - по ГОСТ 22180;
вода дистиллированная - по ГОСТ 6709;
весы лабораторные общего назначения, II класса точности с пределом взвешивания 200 г;
пипетки измерительные градуированные и без промежуточных делений вместимостью 50 и 100 см3 - по ГОСТ 29227;
капельницы (по Строшеину) - по ГОСТ 25336;
бюретки без крана со стеклянным наконечником вместимостью 25 см3 - по ГОСТ 29251;
воронки стеклянные конусообразные № 4 - по ГОСТ 25336;
воронки капельные вместимостью 100 см3 - по ГОСТ 25336;
цилиндры измерительные вместимостью 50, 100, 250, 500 и 1000 см3 - по ГОСТ 1770;
колбы конические широкогорлые вместимостью 100, 250, 500 и 1000 см3 - по ГОСТ 25336;
стаканы химические низкие вместимостью 300 и 500 см3 - по ГОСТ 25336;
колбы мерные вместимостью 250, 500 и 1000 см3 - по ГОСТ 1770;
трубки хлоркальциевые 10/19 - по ГОСТ 25336;
микропроцессор любого типа.
2 МЕТОД ОСАЖДЕНИЯ УГЛЕКИСЛОТЫ ИЗ РАСТВОРА АММИАКА
2.1 Сущность метода состоит в осаждении малорастворимого карбоната кальция путем введения в раствор аммиака избытка хлористого кальция, отделения образовавшегося осадка и измерения его количества.
2.2 Приготовление растворов
2.2.1 Раствор хлористого кальция с массовой долей 5% готовят, растворяя 50 г соли хлористого кальция в 950 см3 дистиллированной воды. Раствор хранят в склянке со стеклянной пришлифованной пробкой.
2.2.2 Раствор гидроокиси натрия концентрации c(NaOH) = 0,1 моль/дм3 приготовляют по ГОСТ 4919.2, разбавляя затем до нужной концентрации. Раствор хранят в склянке, соединенной с бюреткой. Раствор должен быть защищен от доступа углекислоты из воздуха с помощью хлоркальциевых трубок, наполненных натронной известью, или путем присоединения к промывалке с раствором KОН либо NaOH. Титр раствора гидроокиси натрия устанавливают по навеске чистой двухводной щавелевой кислоты. Для этого отвешивают на аналитических весах 0,6303 г щавелевой кислоты, растворяют навеску в дистиллированной воде в мерной колбе вместимостью 100 см3. Доводят объем жидкости в колбе до метки и тщательно перемешивают. Затем отбирают пипеткой не менее трех порций по 10 см3, помещают их в чистые конические колбы вместимостью 100 или 250 см3, приливают свежепрокипяченную и остуженную дистиллированную воду примерно по 30-40 см3 в каждую колбу и вводят по 3-5 капель спиртового раствора фенолфталеина.
Приготовленный раствор титруют раствором щелочи до появления розовой окраски, не исчезающей в течение 1 мин. Количества израсходованного щелочного раствора не должны отклоняться более чем на 0,05 см3.
Концентрацию гидроокиси натрия c(NaOH) = 0,1 моль/дм3 (Kщ) определяют по формуле
, (1)
где m - количество приготовленного раствора щавелевой кислоты, взятое для титрования, см3;
H - концентрация раствора щавелевой кислоты c(1/2Н2С2О4·2Н2О) = 0,1 моль/дм3;
aщ - среднее арифметическое из количеств щелочного раствора, израсходованных на титрование 10 см3 щавелевой кислоты.
2.2.3 Титрованный раствор соляной кислоты концентрации c(HCl) = 0,1 моль/дм3 приготовляют из фиксанала.
Раствор хранят в склянке, соединенной с бюреткой резиновыми трубками.
Концентрацию раствора соляной кислоты c(HCl) = 0,1 моль/дм3 устанавливают по раствору щелочи. Для этого в конические колбы вместимостью по 100 или 250 см3 отбирают не менее трех порций по 10 см3 щелочного раствора, пользуясь бюреткой, присоединенной к сосуду с раствором, вливают в каждую колбу по 30-40 см3 дистиллированной воды и по 3 капли водного раствора метилового оранжевого и титруют окрашенную в желтый цвет жидкость раствором кислоты до изменения цвета в оранжевый.
Расход кислоты на титрование этих порций не должен различаться более чем на 0,05 см3.
Концентрацию раствора кислоты c(НСl) = 0,1 моль/дм3 определяют по формуле
, (2)
где m - количество щелочного раствора, взятого для титрования;
Kщ - концентрация раствора щелочи c(NaOH) = 0,1 моль/дм3;
aк - среднее арифметическое из количеств раствора кислоты, израсходованных на титрование, см3.
2.2.4 Раствор трилона Б 0,05 м концентрации готовят, растворяя 18,61 г этого вещества в литре дистиллированной воды. Молярность раствора устанавливают по фиксанальному раствору соли магния, применяя в качестве индикатора спиртовой раствор эриохром черного Т.
2.2.5 Спиртовой раствор фенолфталеина готовят, растворяя 1 г индикатора в 100 см3 этилового спирта.
2.2.6 Водный раствор метилового оранжевого готовят, растворяя 0,1 г индикатора в 100 см3 дистиллированной воды.
2.2.7 Аммиачную буферную смесь готовят, смешивая 80 см3 водного раствора аммиака с массовой долей 25% и 100 см3 раствора хлористого аммония с массовой долей 20% и доводя объем дистиллированной водой до 1000 см3.
2.2.8 Спирто-аммиачный раствор эриохром черного Т готовят, растворяя 0,5 г индикатора в 20 см3 аммиачной буферной смеси и доводя объем до 100 см3 этиловым спиртом.
2.3 Проведение анализа
Для проведения анализа из емкости (бака) с раствором аммиака или из трубопровода, по которому подают аммиачный раствор к дозирующим устройствам, отбирают около 0,5 дм3 раствора аммиака в чистую склянку с резиновой пробкой.
Перед отбором, открыв кран или вентиль, сбрасывают в дренаж около 1 дм3 аммиачного раствора, затем наполняют склянку и выливают ее содержимое также в дренаж. Лишь после этого отбирают порцию аммиачного раствора (около 0,5 дм3) для анализа.
Пипеткой из склянки отбирают точно 100 см3 раствора аммиака (если раствор с массовой долей 1-1,5%) или точно 25,0 см3 концентрированного раствора.
Отобранное количество помещают в химический стакан вместимостью 250-300 см3, в который предварительно наливается 70-80 см3 дистиллированной воды. При непрерывном перемешивании стеклянной палочкой (под вытяжным шкафом) вводят в жидкость по каплям раствор хлористого кальция, следя за образованием осадка. При этом жидкость нагревают, постепенно доводя ее до кипения. В кипящую жидкость вводят еще 2-3 см3 раствора хлористого кальция (в избыток) и поддерживают кипение до удаления основной массы аммиака.
Образовавшийся осадок быстро отфильтровывают на беззольный фильтр, обмывая стенки стакана, фильтр и осадок горячей дистиллированной водой. Фильтр с осадком опускают в стакан, где проводилось осаждение. На стенках этого стакана обычно остаются частички карбоната кальция. В стакан вливают точно отмеренный объем раствора соляной кислоты концентрации c(НСl) = 0,1 моль/дм3, достаточный для растворения всего углекислого кальция как с фильтра, так и со стен стакана (если введено недостаточное количество кислоты, ее добавляют, точно учитывая общее количество введенной кислоты).
Дальнейший анализ может выполняться двумя способами.
2.3.1 В жидкость вливают 100 см3 дистиллированной воды и от 3 до 5 капель индикатора метил-оранжа. Раствор должен быть окрашен в красный цвет. Его титруют раствором гидроокиси натрия концентрации (NaOH) = 0,1 моль/дм3 до перехода окраски в оранжево-желтую.
2.3.2 Жидкость титруют 0,05 м раствором трилона Б. Для этого кислый раствор нагревают до кипения для удаления СО2, затем после охлаждения добавляют 5 см3 аммиачной буферной смеси, 5-7 капель индикатора эриохром черного и титруют окрашенную в виннокрасный цвет жидкость 0,05 м раствором трилона Б до изменения цвета жидкости в сине-фиолетовый.
2.4 Обработка результатов анализа
2.4.1 По п.2.3.1 концентрацию углекислоты (СО2) в аммиачном растворе определяют по формуле (г/кг)
, (3)
где Kк и Kщ - концентрации растворы соляной кислоты c(НСl) = 0,1 моль/дм3 и гидроокиси натрия c(NaOH) = 0,1 моль/дм3;
V - объем аммиачного раствора взятый для анализа, см3;
aк и ащ - объемы кислоты и щелочи концентрации c(НСl) и (NaOH) 0,1 моль/дм3, использованная для растворения СаСО3 и оттитровывания избытка кислоты, см3;
2,2 - десятая часть эквивалентной массы (СО2) в данной реакции.
2.4.2 По п.2.3.2 концентрацию углекислоты (СО2) в аммиачном растворе определяют (г/кг) по формуле
, (4)
где ат - расход раствора трилона, см3;
Kт - молярность раствора трилона;
4,4 - десятая часть молекулярного веса;
V - объем аммиачного раствора, см3.
2.4.3 Результаты определений округляются до сотых долей.
3 МЕТОД ВЫТЕСНЕНИЯ УГЛЕКИСЛОТЫ ИЗ АММИАЧНОГО РАСТВОРА
3.1 Сущность метода состоит в вытеснении углекислоты током воздуха из подкисленного раствора аммиака и поглощении ее титрованным раствором барита.
Метод применяется при содержании углекислоты в растворе аммиака не менее 50 мг/кг.
3.2 Приготовление растворов
3.2.1 Раствор соляной кислоты концентрации c(НСl) = 0,1 моль/дм3 готовят по п.2.2.3.
3.2.2 Раствор фенолфталеина готовят по п.2.2.5.
3.2.3 Раствор гидроокиси бария должен содержать около 4 г/дм3 кристаллогидрата Ва(ОН)2·8Н2О, т.е. быть примерно 0,012-м. Сначала готовят насыщенный раствор гидроокиси бария. Его растворимость сильно зависит от температуры (при 20 °C - 39 г/дм3, при 40 °C - 82 г/дм3, при 60 °C - 209 г/дм3). Насыщенный раствор при спокойном отстаивании осветляется. Для приготовления рабочего раствора пипеткой отбирают 10 см3 прозрачного насыщенного раствора и вливают в 90 см3 прокипяченной дистиллированной воды. Приготовленный рабочий хранят хорошо защищенным от доступа углекислоты, используя хлоркальциевые трубки, наполненные натронной известью, или присоединяя раствор к поглотительной склянке, содержащей раствор NаОН или KОН.
3.3 Подготовка к проведению анализа
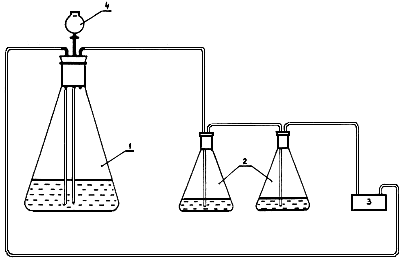
Для проведения анализа собирают прибор в соответствии с рисунком 1.
Рисунок 1 - Прибор для определения малых количеств углекислоты в аммиаке
Широкогорлую колбу (1) вместимостью 1000 см3 с пробкой, имеющей три отверстия, соединяют с двумя поглотителями (2) и микрокомпрессором (3). В третье отверстие пробки, закрывающей колбу (1), вставляют капельную воронку (4), конец которой должен на 0,5-1,0 см не доходить до дна колбы.
3.4 Проведение анализа
В колбу (1) прибора вводят 200 см3 свежепрокипяченной охлажденной дистиллированной воды и 10-15 см3 концентрированной серной кислоты. Жидкость перемешивают. Затем в каждую поглотительную колбу (2) вводят по 20-30 см3 свежепрокипяченной охлажденной дистиллированной воды и точно отмеривают пипеткой по 10 см3 прозрачного раствора Ba(OH2). Присоединяют поглотители к микрокомпрессору, после чего через капельную воронку вводят в колбу (1) не более 100 см3 разбавленного раствора аммиака или не более 10 см3 концентрированного раствора аммиака
После ввода порции аммиака жидкость в колбе 1 осторожно перемешивают, через капельную воронку вливают в колбу 20-30 см3 дистиллированной воды, затем соединяют колбу 1 с микрокомпрессором и поглотителями и включают микрокомпрессор на 1,5-2 ч.
После отключения микрокомпрессора отсоединяют поглотители, обмывают концы трубок дистиллированной водой, вводят по 3-5 капель спиртового раствора фенолфталеина и окрашенную в красный цвет жидкость оттитровывают раствором соляной кислоты концентрации c(НСl) = 0,1 моль/дм3 до исчезновения красной окраски жидкости.
Появление в дальнейшем розовой окраски жидкости не влияет на результаты анализа.
3.5 Обработка результатов анализа
Концентрацию углекислоты (СО2) в анализируемом растворе аммиака (г/кг) определяют по формуле
, (5)
где a - расход раствора соляной кислоты концентрации c(НСl) = 0,1 моль/дм3 на 10 см3 баритового раствора, см3;
a1 и a2 - расходы раствора соляной кислоты концентрации c(НСl) = 0,1 моль/дм3на титрование избытка (Ва(ОН)2) в первом и втором поглотителях, см3;
Kк - концентрация раствора соляной кислоты c(НСl) = 0,1 моль/дм3;
22 - эквивалентная масса (СО2) в данной реакции;
V - объем аммиачного раствора, взятый для анализа, см3.
4 ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ АНАЛИЗА
Результаты анализа записывают в отдельном журнале, в котором указывают следующие данные.
На титульном листе журнала: наименование методики и ее обозначение.
На первой странице: дата проведения анализа, дата отбора пробы, место отбора, результаты анализа (содержание углекислоты в растворе аммиака), г/кг.
Каждый анализ подписывает работник, выполнивший анализ.
Приложение А
Справочное
Перечень нормативно-технических документов, на которые имеются ссылки в РД 34.37.509-83
Обозначение НТД | Пункт, в котором имеется ссылка |
ГОСТ 1770-74 | 1 |
ГОСТ 3118-77 | 1 |
ГОСТ 3760-79 | 1 |
ГОСТ 3773-72 | 1 |
ГОСТ 4107-78 | 1 |
ГОСТ 4328-77 | 1 |
ГОСТ 4919.2-77 | 2.2.2 |
ГОСТ 6709-72 | 1 |
ГОСТ 10652-73 | 1 |
ГОСТ 18300-87 | 1 |
ГОСТ 22180-76 | 1 |
ГОСТ 25336-82 | 1 |
ГОСТ 29227-91 | 1 |
ГОСТ 29251-91 | 1 |
ТУ 6-09-2540-87 | 1 |
ТУ 6-09-4530-77 | 1 |
ТУ 6-09-4711-81 | 1 |
ТУ 6-09-4772-79 | 1 |
ТУ 6-09-5360-87 | 1 |