РД 34.37.528-94
РОССИЙСКОЕ АКЦИОНЕРНОЕ ОБЩЕСТВО ЭНЕРГЕТИКИ И ЭЛЕКТРИФИКАЦИИ "ЕЭС РОССИИ"
Департамент научно-технической политики и развития
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ СОДЕРЖАНИЯ НАТРИЯ В ТЕХНОЛОГИЧЕСКИХ ВОДАХ ТЭС ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ С ПОМОЩЬЮ ЛАБОРАТОРНЫХ ИОНОМЕРОВ
РД 34.37.528-94
УДК 628.034:543.257.3
Срок действия с 01.01.94
до 01.01.99
РАЗРАБОТАНО Акционерным обществом "Фирма по наладке, совершенствованию технологии и эксплуатации электростанций и сетей ОРГРЭС"
Исполнители Р.Л. Медведева, И.В. Никитина (ВХЦ); А.Г. Ажикин, В.И. Чубатый, Л.В. Соловьева, С.А. Спорыхин, В.И. Осипова (ЦИТМ)
УТВЕРЖДЕНО Департаментом науки и техники РАО "ЕЭС России" 14.04.94 г.
Первый заместитель начальника А.П. Берсенев
1. НАЗНАЧЕНИЕ И ОБЛАСТЬ ПРИМЕНЕНИЯ
1.1. Методика устанавливает порядок определения содержания натрия в технологических водах ТЭС (далее по тексту - в водах), требования к методу и средствам измерений, алгоритмы подготовки, проведения измерений и обработки результатов определения.
1.2. Методика обеспечивает получение достоверных характеристик погрешности определения содержания натрия при принятой доверительной вероятности и способы их выражения.
1.3. Результаты определения содержания натрия используются для контроля за качеством технологических вод тепловых электростанций, которое регламентируется "Правилами технической эксплуатации электрических станций и сетей" (М.: Энергоатомиздат, 1989).
2. СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНЫЕ УСТРОЙСТВА, ПОСУДА, РЕАКТИВЫ И РАСТВОРЫ
2.1. Иономер лабораторный И-130
Диапазон измерений в режиме измерений электродвижущей силы (ЭДС) - от минус 2000 до плюс 2000 мВ.
Пределы допустимых значений основной абсолютной погрешности
где x - значение измеряемой величины, мВ.
Возможно использование другого прибора, метрологические характеристики которого не хуже, чем у указанного иономера.
2.2. Весы лабораторные аналитические ВЛР-200.
Диапазон измерения 0÷200 г.
Класс точности 2.
Цена деления 1 мг.
2.3. Термометр лабораторный ТЛ-2.
Цена деления 1 °С.
2.4. Натрий-селективный электрод ЭС-10-07 (ТУ-25-0519.072-86).
Электрод предназначен для измерения активной концентрации ионов натрия в водных растворах. Потенциал электрода в растворе хлористого натрия с массовой долей натрия 0,1 моль/дм3 при температуре 25 °C относительно хлорсеребряного электрода равен (90±20) мВ.
Присутствие ионов кальция и магния не мешает определению натрия, если массовая доля их не превышает массовой доли ионов натрия соответственно в 10 и 500 раз.
Ионы водорода мешают работе Na-селективного электрода. Для нормальной работы электрода концентрация ионов натрия должны превышать концентрацию ионов водорода в 103-104 раз, поэтому при изменении малых количеств ионов Na необходимо поддерживать рН контролируемой воды в пределах 10,3±0,5, что осуществляется насыщением анализируемой воды парами аммиака.
Для приведения в рабочее состояние новый электрод следует замочить в 0,1 моль/дм3 растворе хлористого натрия в течение 2 мес. Нельзя допускать высыхания электрода. Между анализами его следует оставлять в ячейке или полиэтиленовом стакане с обессоленной водой, а на длительный срок - в 0,1 моль/дм3 растворе хлористого натрия.
2.5. Вспомогательный хлорсеребряный электрод ЭВЛ-1 МЗ (ТУ 25.05.2181-77).
2.6. Проточная ячейка, изготовленная из органического стекла.
2.7. Устройство для подщелачивания пробы аммиачным паром, состоящее из полиэтиленовой банки вместимостью 0,5 л с плотно закрытой крышкой и силиконового шланга, средняя часть которого находится внутри сосуда, а концы выведены наружу через отверстия в пробке. Банка заполнена 25%-ным раствором аммиака.
2.8. Колбы мерные:
тип 2-1000-2 (ГОСТ 1770-74);
тип 2-500-2 (ГОСТ 1770-74).
Пипетки:
тип 6-2-50 (ГОСТ 1770-74).
2.9. Вода обессоленная (ОСТ 34-70-953.2-88) с удельной электрической проводимостью не более 0,1 мкСм/см.
2.10. Для приготовления стандартного раствора используется фиксанал 0,1 н NaCl ОСЧ МРТУ 6-09-292-70. Массовая концентрация натрия в этом растворе составляет 2,3 г/дм3. (При отсутствии фиксанала используется хлорид натрия ХЧ ГОСТ 4233-77). Навеска 5,85 г хлористого натрия, предварительно высушенного в течение 1-2 ч при температуре 110 °C, растворяется в обессоленной воде, переносится в мерную колбу вместимостью 1 л и доводится до метки. Этот раствор содержит 2,3 г/дм3 натрия. Из основного раствора последующим разбавлением готовятся растворы меньших концентраций. Все растворы готовятся на обессоленной воде.
3. МЕТОД ИЗМЕРЕНИЙ
3.1. Метод основан на измерении ЭДС электрохимической ячейки, в которую помещается дистиллированная вода или анализируемый раствор и электродная система, состоящая из измерительного (Na-селективного) электрода и электрода сравнения. Электродвижущая сила, развиваемая электродной системой, прямо пропорциональна определяемой величине pNa.
Зависимость потенциала электрода от активности потенциалобразующих ионов в растворе может быть выражена уравнением Нернста
, (1)
где a - активная концентрация потенциалобразующих ионов, г - ион/дм3;
E0 - нормальный или стандартный электродный потенциал, численно равный E при a = 1;
R - универсальная газовая постоянная, равная 8,314 Дж/(град·моль);
T - абсолютная температура, К;
n - число электронов, переносимых в процессе реакции, или заряд потенциалобразующего иона;
F - число Фарадея, равное 96500 Кл.
В сильно разбавленных водных растворах, т.е. в водах типа конденсата, активность ионов практически равна их концентрации. В этом случае, приняв температуру анализируемого раствора (25±1) °С и выразив постоянные R и F через их численные значения, а натуральные логарифмы через десятичные, можно получить упрощенное выражение уравнения Нернста
Ex = E0 + 0,059 lgC, (2)
где C - концентрация потенциалобразующих ионов, т.е. натрия.
Таким образом, ЭДС электродной системы в анализируемом растворе связана с концентрацией ионов натрия логарифмической зависимостью. Для удобства используется величина
pNa = - lg CNa, (3)
где CNa - концентрация ионов натрия, моль/дм3.
3.2. Метод позволяет контролировать содержание ионов натрия в воде в диапазоне концентраций от 0,7 до 2,3·106 мкг/дм3.
3.3. Продолжительность определения в единичной пробе при готовых калибровочных растворах и настроенной аппаратуре составляет 3-5 мин.
Температура контролируемого раствора в ячейке (25±1) °С.
4. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
4.1. Работа с иономером должна проводиться в соответствии с инструкцией по эксплуатации.
4.2. При приготовлении и использовании растворов стандартных образцов следует выполнять требования безопасности в соответствии с ГОСТ 12.1.005-76 и ГОСТ 12.1.007-76.
4.3. При заполнении сосуда с концентрированным аммиаком следует соблюдать требования техники безопасности в соответствии с "Правилами техники безопасности при эксплуатации тепломеханического оборудования электростанций и тепловых сетей" (М.: Энергоатомиздат, 1985).
5. ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ПЕРСОНАЛА
К выполнению определений допускаются лица, имеющие среднее образование и практический опыт работы в химической лаборатории не менее 3 мес.
6. ПОДГОТОВКА К ВЫПОЛНЕНИЮ ОПРЕДЕЛЕНИЯ
6.1. Проба воды отбирается непосредственно перед определением в плотно закрытые полиэтиленовые банки, предварительно промытые анализируемой водой, вместимостью не менее 0,5 л. Температура пробы при определении концентрации натрия должна быть (25±1) °С.
6.2. Подготовить к работе иономер в соответствии с заводской инструкцией, включить шкалу - мВ. Следует помнить, что потенциал электрода имеет как положительное, так и отрицательное значение в зависимости от концентрации ионов натрия.
6.3. Проверка работоспособности электрода осуществляется следующим образом.
Определение рабочих характеристик электрода (потенциала и крутизны электродной функции), а также работу с растворами с массовой концентрацией натрия более 2·103 мкг/дм3 можно проводить в статических условиях. Ионселективный и вспомогательный электроды помещаются в полиэтиленовый стакан, заполненный 0,1 М раствором хлористого натрия, определяется потенциал ионселективностью электрода, который, согласно паспортным данным, должен составлять (90±20) мВ.
Для определения крутизны электродной функции данного электрода Ke определяются потенциалы электрода в растворах хлористого натрия концентраций 0,01 М, 0,001 М и 0,0001 М. Из предыдущих значений потенциалов вычитаются последующие:
E0,1M – E0,01M = K1;
E0,01M – E0,001M = K2;
E0,001M – E0,0001M = K3.
За Ke принимается среднее значение из трех полученных данных:
. (4)
Согласно уравнению (2), разность этих потенциалов при изменении значения pNa на 1 должна составлять 0,59 мВ. Реально это значение может отличаться от теоретического на 3-7 мВ, но оно должно быть постоянным на всех диапазонах. Затем диапазоны разбиваются на отрезки, например 0,05 pNa, эти значения рассчитываются, логарифмируются и сводятся в таблицу. Эта таблица может быть продлена до значений pNa = 7,5, поскольку крутизна электродной функции данной электродной системы остается постоянной на всех диапазонах pNa, а приготовление сильно разбавленных растворов с концентрацией 10-6-10-5 г/дм3 может привести к значительной ошибке разбавления.
7. ВЫПОЛНЕНИЕ ОПРЕДЕЛЕНИЯ
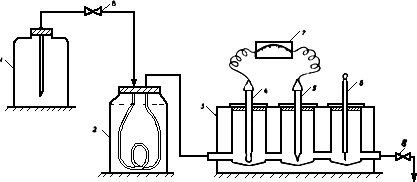
7.1. Собирается установка в соответствии с рисунком (соединяется устройство для подготовки пробы с проточной ячейкой), и вся система заполняется обессоленной водой. Электроды промываются обессоленной водой и помещаются в проточную ячейку. Первым на пути движения пробы ставится ионселективный электрод.
Установка для определения содержания натрия потенциометрическим методом:
1 - сосуд с обессоленной водой или анализируемой пробой; 2 - сосуд для подщелачивания пробы парами аммиака; 3 - проточная ячейка; 4 - измерительный электрод; 5 - электрод сравнения; 6 - термометр; 7 - иономер; 8 - зажим
7.2. Устанавливается скорость протока обессоленной воды 40-50 мл/мин. Проверяется на выходе значение pH и при необходимости регулируется до 10,3±0,5 длиной погружения в аммиак силиконовой трубки или скоростью пропуска пробы.
Пропускается обессоленная вода, насыщенная аммиаком, через проточную ячейку до тех пор, пока ячейка и электроды не отмоются от следов натрия и стрелка гальванометра не остановится на 250-270 мВ.
7.3. Отсоединяется сосуд с обессоленной водой и присоединяется сосуд с анализируемой пробой. Температура пробы должна быть (25±1) °С.
Время установления показаний иономера при малых концентрациях иона натрия 0,5-1 мин. Отсчет производится через 20-30 с после остановки стрелки гальванометра.
8. РАСЧЕТ СОДЕРЖАНИЯ НАТРИЯ В ПРОБЕ
8.1. Определяется величина pNa анализируемого раствора по формуле
, (5)
где E - потенциал электрода в растворе 0,1 М NaCl, мВ;
E1 - потенциал электрода в анализируемом растворе, мВ;
Ke - крутизна электродной функции данного электрода, мВ.
8.2. После получения значения pNa по табл. 2 находится содержание натрия в мкг/дм3.
8.3. Можно определить концентрацию ионов натрия по калибровочной кривой. Для этого необходимо определить потенциалы электрода в стандартных растворах с известной концентрацией натрия. По данным измерений строится калибровочный график E (мВ) - pNa, затем измеряется потенциал электрода в контролируемом растворе и графически определяется значение pNa неизвестного раствора.
9. АЛГОРИТМ ОБРАБОТКИ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ ПРИ ОПРЕДЕЛЕНИИ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ КОНЦЕНТРАЦИИ НАТРИЯ
9.1. Доверительная вероятность P при проведении эксперимента принимается равной 0,95.
9.2. Количество наблюдений содержания натрия для каждой концентрации определяется по формуле
. (6)
При P = 0,95 n = 40.
Результаты наблюдений помещены в табл.1.
Таблица 1
Результат измерения содержания натрия в стандартных растворах
Диапазон измерений, мкг/дм3 | Нижняя граница (наименьшее значение), мкг/дм3 | Верхняя граница (наибольшее значение), мкг/дм3 |
0,7-10 | Cl = 0,36+0,983С | Ch = 0,46+1,26С |
10÷2,3·104 | Cl = 0,76+0,943С | Ch = 0,18+1,29С |
2,3·104÷2,3·107 | Cl = 2150+0,85С | Ch = 4697+1,085C |
Примечание. C - значение концентрации натрия, определенное по табл.2. | ||
Таблица 2
Пересчет pNa в массовую концентрацию Na
pNa | мкг/дм3 |
7,50 | 0,73 |
7,45 | 0,82 |
7,40 | 0,92 |
7,35 | 1,03 |
7,30 | 1,15 |
7,25 | 1,29 |
7,20 | 1,45 |
7,15 | 1,63 |
7,10 | 1,83 |
7,05 | 2,05 |
7,00 | 2,30 |
6,95 | 2,58 |
6,90 | 2,90 |
6,85 | 3,25 |
6,80 | 3,65 |
6,75 | 4,09 |
6,70 | 4,59 |
6,65 | 5,15 |
6,60 | 5,78 |
6,55 | 6,48 |
6,50 | 7,27 |
6,45 | 8,16 |
6,40 | 9,16 |
6,35 | 10,27 |
6,30 | 11,53 |
6,25 | 12,93 |
6,20 | 14,51 |
6,15 | 16,28 |
6,10 | 18,27 |
6,05 | 20,50 |
6,00 | 23,00 |
5,95 | 25,81 |
5,90 | 28,96 |
5,85 | 32,49 |
5,80 | 36,45 |
5,75 | 40,90 |
5,70 | 45,89 |
5,65 | 51,49 |
5,60 | 57,77 |
5,55 | 64,82 |
5,50 | 72,73 |
5,45 | 81,61 |
5,40 | 91,56 |
5,35 | 102,74 |
5,30 | 115,27 |
5,25 | 129,34 |
5,20 | 145,12 |
5,15 | 162,83 |
5,10 | 182,70 |
5,05 | 204,99 |
5,00 | 230,00 |
4,95 | 258,06 |
4,90 | 289,55 |
4,85 | 324,88 |
4,80 | 364,53 |
4,75 | 409,00 |
4,70 | 458,91 |
4,65 | 514,91 |
4,60 | 577,73 |
4,55 | 648,23 |
4,50 | 727,32 |
4,45 | 816,07 |
4,40 | 915,65 |
4,35 | 1027,37 |
4,30 | 1152,73 |
4,25 | 1293,39 |
4,20 | 1451,20 |
4,15 | 1628,28 |
4,10 | 1826,95 |
4,05 | 2049,88 |
4,00 | 2300,00 |
3,95 | 2580,64 |
3,90 | 2895,53 |
3,85 | 3248,84 |
3,80 | 3645,25 |
3,75 | 4090,04 |
3,70 | 4589,10 |
3,65 | 5149,06 |
3,60 | 5777,34 |
3,55 | 6482,28 |
3,50 | 7273,24 |
3,45 | 8160,71 |
3,40 | 9156,46 |
3,35 | 10273,72 |
3,30 | 11527,31 |
3,25 | 12933,85 |
3,20 | 14512,02 |
3,15 | 16282,75 |
3,10 | 18269,55 |
3,05 | 20498,77 |
3,00 | 23000,00 |
2,95 | 25806,42 |
2,90 | 28955,28 |
2,85 | 32488,36 |
2,80 | 36452,54 |
2,75 | 40900,43 |
2,70 | 45891,03 |
2,65 | 51490,59 |
2,60 | 57773,39 |
2,55 | 64822,81 |
2,50 | 72732,39 |
2,45 | 81607,08 |
2,40 | 91564,65 |
2,35 | 102737,23 |
2,30 | 115273,06 |
2,25 | 129338,50 |
2,20 | 145120,19 |
2,15 | 162827,53 |
2,10 | 182695,49 |
2,05 | 204987,72 |
2,00 | 230000,00 |
1,95 | 258064,24 |
1,90 | 289552,84 |
1,85 | 324883,64 |
1,80 | 364525,43 |
1,75 | 409004,26 |
1,70 | 458910,33 |
1,65 | 514905,86 |
1,60 | 577733,88 |
1,55 | 648228,07 |
1,50 | 727323,86 |
1,45 | 816070,80 |
1,40 | 915646,49 |
1,35 | 1027372,26 |
1,30 | 1152730,64 |
1,25 | 1293385,05 |
1,20 | 1451201,89 |
1,15 | 1628275,30 |
1,10 | 1826954,94 |
1,05 | 2049877,16 |
1,00 | 2300000,00 |
9.3. Оценивается погрешность определений.
9.3.1. Определяется систематическая составляющая погрешности
мкг/дм3, (7)
где Ci - i-й результат определения содержания натрия (i = 1, …, 40);
Сд - действительное содержание натрия.
9.3.2. Определяется среднеквадратическое отклонение случайной составляющей погрешности
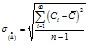
9.3.3. Определяются границы, в которых с вероятностью Р=0,95 находится погрешность измерений
, (9)
где Δl(h) - нижняя (верхняя) граница погрешности измерений;
tp - коэффициент, зависящий от заданной вероятности и числа наблюдений.
При P = 0,95 и n = 40 tp = 1,96.
9.3.4. Определяются границы, в которых с вероятностью P = 0,95 находится результат измерения:
(10)
10. НОРМЫ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ, ФОРМЫ ПРЕДСТАВЛЕНИЯ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ СОДЕРЖАНИЯ НАТРИЯ
10.1. Нормы погрешности измерений содержания натрия в водах в нормативно-технических документах не установлены.
10.2. Результат измерения, согласно МИ 1317-86, представляется в следующей форме:
Cl до Ch; P,
где Cl, Ch - нижняя и верхняя границы, в пределах которых находится результат измерения с заданной доверительной вероятностью, мкг/дм3;
P - доверительная вероятность, с которой результат измерения находится в пределах нижней и верхней границ, принимается равной 0,95.
10.3. Результат измерения содержания натрия для различных концентраций определяется по табл. 1 с доверительной вероятностью 0,95.