РД 34.50.503.2-93
РОССИЙСКОЕ АКЦИОНЕРНОЕ ОБЩЕСТВО ЭНЕРГЕТИКИ И ЭЛЕКТРИФИКАЦИИ "ЕЭС РОССИИ"
Департамент науки и техники
МЕТОДИКА
ПО ОПРЕДЕЛЕНИЮ СОДЕРЖАНИЯ ХЛОРИДОВ В ЭЛЕКТРОЛИТЕ ЭЛЕКТРОЛИЗНЫХ УСТАНОВОК ТЭС ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ
РД 34.50.503.2-93
Срок действия с 01.01.94
до 01.01.99
РАЗРАБОТАНА АО "Фирма по наладке, совершенствованию технологии и эксплуатации электростанций и сетей ОРГРЭС"
Исполнители Р.Л. Медведева, И.В. Никитина (ВХЦ); С.А. Спорыхин, Л.В. Соловьева (ЦИТМ)
УТВЕРЖДЕНА Департаментом науки и техники РАО "ЕЭС России" 27.12.93 г.
Первый заместитель начальника А.П. БЕРСЕНЕВ
Методика регламентирует порядок проведения количественного химического анализа проб электролита электролизных установок ТЭС потенциометрическим методом для определения в них содержания хлоридов, устанавливает требования к используемым средствам измерений, алгоритму проведения измерений и обработке результатов.
Методика обеспечивает получение достоверных характеристик погрешности определения содержания хлоридов в электролите при принятой доверительной вероятности и способы их выражения.
Результаты определения содержания хлоридов в электролите используют для контроля качества электролита электролизных установок ТЭС, которые регламентируются "Типовой инструкцией по эксплуатации электролизных установок для получения водорода и кислорода: ТИ 34-70-056-86". (М.: СПО Союзтехэнерго, 1986).
1. СВЕДЕНИЯ ОБ ОБЪЕКТЕ КОНТРОЛЯ
1.1. Электролит используют для получения водорода в электролизных установках ТЭС, применяемого в системах охлаждения генераторов и синхронных компенсаторов.
1.2. Электролит представляет собой раствор гидроксида калия с концентрацией основного вещества KOH 390-400 г/дм3.
1.3. В процессе эксплуатации происходит загрязнение электролита различными примесями и продуктами коррозии, что приводит к ухудшению технологических характеристик оборудования.
1.4. Для обеспечения экономичной и безопасной работы электролизера требуется контроль качества электролита с целью поддержания в нем соединений хлоридов в пределах нормы - не более 6 г/дм3 (см. Типовую инструкцию по эксплуатации электролизных установок для получения водорода и кислорода).
2. СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНЫЕ УСТРОЙСТВА, ПОСУДА, РЕАКТИВЫ И РАСТВОРЫ
При определении содержания хлоридов следует применять средства измерений, вспомогательные устройства (ВУ), посуду, реактивы и растворы, перечень которых приведен в табл.1-4.
Таблица 1
Средства измерений
Наименование | Тип | Диапазон измерений | Класс точности или предел допустимой погрешности | Примечание |
1. Иономер | ЭВ-74 | -(100÷400) мВ | ±2,3 мВ | |
2. Весы лабораторные аналитические | ВЛР-200 | (0÷200) г | 2,0 | |
3. Термометр лабораторный | ТЛ-2 | (0÷100) °С | Цена деления 1 °С | |
4. Хлор-селективный твердоконтактный электрод | ЭК-041401 | 1·10-4÷1·10-1 моль/дм3 | КСРШ418422.037.TУ | |
5. Вспомогательный хлор-серебряный электрод | ЭВЛ-1М3.1 | ТУ 25.05.2181-77 |
Примечание. Принцип работы хлор-селективного твердоконтактного электрода основан на селективном обмене между ионами мембраны и ионами хлора, содержащимися в анализируемом растворе.
Электрод селективен в присутствии бромид-ионов и иодид-ионов. Мешающие ионы: S2-, CN-; .
Оптимальное значение рабочей области 2-11 ед. pH.
Крутизна хлоридной функции электрода при t = 25 °С составляет (54±4) мВ/pCl.
Электрод хранят в сухом виде.
Таблица 2
Вспомогательные устройства
Наименование ВУ | Требования к ВУ |
1. Электролитический ключ | См. примечание |
2. Шнур из асбестового волокна | Шнур предварительно кипятят в дистиллированной воде (10-15 мин) |
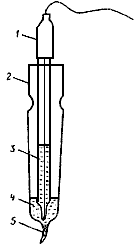
Примечание. Электролитический ключ (рис.1) представляет собой стеклянную ячейку с капилляром, который заполнен асбестовым волокном. В ячейку наливают насыщенный раствор нитрата калия и помещают электрод сравнения.
Рис. 1. Электролитический ключ:
1 - электрод сравнения; 2 - стеклянная ячейка с капилляром;
3 - насыщенный раствор KCl; 4 - насыщенный раствор KNO3; 5 - асбестовый шнур
Таблица 3
Посуда
Наименование | Тип | НТД |
1. Колбы мерные | 2-1000-2, | ГОСТ 1770-74 |
2-100-2 | ГОСТ 1770-74 | |
2. Стакан мерный вместимостью 50 см3 | Н-1-50 ТХС | ГОСТ 25336-82 |
3. Пипетки | 6-2-10, | ГОСТ 20292-74 |
6-2-5 | ГОСТ 20292-74 |
Приведенные в табл.1 и 3 средства измерений и посуда могут быть заменены аналогичными с характеристиками не хуже указанных.
Таблица 4
Растворы и реактивы
Наименование | Классификация | НТД | Примечание |
1. Вода дистиллированная Н2О | ГОСТ 6709-72 | Воду следует предохранять от попадания паров соляной кислоты и углекислоты из воздуха | |
2. Уксусная кислота CH3СООН | "х.ч." | ГОСТ 61-75 | |
3. Буферный раствор стандарт-титр натрий тетра-борнокислый Na2B4O710H2O | ГОСТ 8.135-74 | рН-9,18 | |
4. Насыщенный раствор хлористого калия KCl | "ч.д.а." | ГОСТ 4234-77 | |
5. Насыщенный раствор азотнокислого калия KNO3 | "ч." | ГОСТ 4217-77 |
Приготовление рабочих и стандартных растворов
1. Для приготовления стандартного раствора используют фиксанал 0,1 N NaCI "о.с.ч." (МРТУ 6-09-292-70), растворенный в 0,1 М растворе KNO3, массовая концентрация хлора в этом растворе составляет 3,55 г/дм3. (При отсутствии фиксанала используют хлорид натрия "х.ч." (ГОСТ 4233-77). Навеску 5,845 г хлористого натрия, предварительно высушенного в течение 1-2 ч при температуре 110 °С, растворяют в 0,1 М растворе KNO3, переносят в мерную колбу на 1 дм3 и доводят до метки. Этот раствор содержит 3,55 г/дм3 хлора.
Из основного раствора последующим разбавлением в 0,1 М KNO3 готовят растворы меньших концентраций.
2. 0,1 М раствор KNO3. Навеску нитрата калия 10,1 г растворяют в дистиллированной воде, переносят в мерную колбу на 1 дм3 и доводят до метки.
3. МЕТОД ИЗМЕРЕНИЙ
3.1. Сущность метода
Метод основан на измерении электродвижущей силы (ЭДС) электродной системы, состоящей из измерительного электрода (Cl-селективного) и электрода сравнения. ЭДС, развиваемая электродной системой, прямо пропорциональна определяемому значению pCl.
Зависимость потенциала электрода от активности потенциалообразующих ионов в растворе выражается уравнением Нернста
, (1)
где a - активная концентрация потенциалообразующих ионов, г-ион/дм3;
E - нормальный или стандартный электродный потенциал, численно равный E° при a = 1;
R - универсальная газовая постоянная, равная 8,314 Дж/(град·моль);
T - абсолютная температура, K;
n - число электронов, переносимых в процессе реакции, или заряд потенциалообразующего иона;
F - число Фарадея, равное 96500 Кл.
Выразив постоянные величины R и F через их численные значения, а натуральные логарифмы через десятичные, получим упрощенное выражение уравнения Нернста
Ex = E° + 0,059 lg C, (2)
где C - концентрация потенциалообразующих ионов, т.е. хлора.
Таким образом, ЭДС электродной системы в анализируемом растворе связана с концентрацией ионов хлора логарифмической зависимостью
pCl = -lg CCl, (3)
где CCl - концентрация ионов хлора, моль/дм3.
3.2. Диапазон измеряемых концентраций
Метод позволяет контролировать содержание ионов хлора в растворе в диапазоне концентраций от 3,55·103 мкг/дм3 до 3,55·106 мкг/дм3.
3.3. Продолжительность определения
Продолжительность определения в единичной пробе при готовых калибровочных растворах и настроенной аппаратуре составляет около 1 мин.
4. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
4.1. Работа с иономером должна проводиться в соответствии с требованиями инструкции по эксплуатации.
4.2. При работе с уксусной кислотой следует выполнять требования безопасности в соответствии с "Правилами техники безопасности при эксплуатации тепломеханического оборудования электростанций и тепловых сетей". (М.: Энергоатомиздат, 1985).
4.3. При приготовлении и использовании стандартных растворов следует выполнять требования безопасности в соответствии с ГОСТ 12.1.005-88 и ГОСТ 12.1.007-76.
5. ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ПЕРСОНАЛА
К выполнению анализа допускаются лица, имеющие среднее образование и практический опыт работы в химической лаборатории не менее 3 мес.
6. ПОДГОТОВКА К ВЫПОЛНЕНИЮ АНАЛИЗА
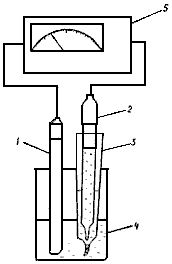
6.1. Собрать установку в соответствии с рис.2.
В стеклянный сосуд, заполненный анализируемым раствором или дистиллированной водой, поместить измерительный электрод и электрод сравнения. Подключить электроды к прибору.
6.2. Подготовить иономер к работе в соответствии с требованиями заводской инструкции.
6.3. Проверить работоспособность ион-селективного электрода.
Перед началом работы промыть электрод в течение 10-15 мин в дистиллированной воде. Произвести измерение потенциала в воде, а затем в 0,1 М растворе KNO3. Электрод готов к работе, если потенциал электрода, измеренный в дистиллированной воде, отличается от потенциала в 0,1 М растворе KNO3 на 20-30 мВ. Если разность потенциалов отличается от указанного, необходимо повторить отмывку электрода с контролем потенциала.
6.4. Определить крутизну электрода, для чего приготовить калибровочные растворы. Из исходного раствора (10-1 моль/дм3 NaCl) последующим разбавлением в 0,1 М растворе KNO3 приготовить растворы следующих концентраций: 10-2; 10-3; 10-4 моль/дм3.
В стеклянный стакан поместить 25 см3 каждого раствора и добавить по 10 см3 буферного раствора.
Произвести измерение потенциалов E калибровочных растворов и рассчитать крутизну электродной функции Ke.
E0,1M – E0,01M = K1;
E0,01M – E0,001M = K2; (4)
E0,001M – E0,0001M = K3.
За Ke принимаем среднее значение из трех полученных данных
. (5)
Рис. 2. Установка для определения хлоридов потенциометрическим методом:
1 - хлор-селективный электрод; 2 - вспомогательный электрод; 3 - электролитический ключ; 4 - анализируемая проба; 5 - иономер
7. ВЫПОЛНЕНИЕ АНАЛИЗА
7.1. Подготовка пробы
При анализе электролита потенциометрическим методом для определения содержания хлоридов не требуется особой подготовки пробы. Однако, исходя из технических характеристик Cl-селективного электрода, необходимо щелочной раствор электролита нейтрализовать уксусной кислотой до рН 8-9 по индикаторной бумаге.
7.2. Анализ пробы
Определяемый объем электролита (10 см3) поместить в мерный стакан вместимостью 50-100 см3. Нейтрализовать 5-7 см3 уксусной кислоты по каплям; проверить рН раствора, который должен быть в пределах 8-9.
Объем анализируемого раствора довести до 25 см3 дистиллированной водой или нитратом калия, прибавить 10 см3 боратно-буферного раствора и измерить потенциал в анализируемом растворе.
8. РАСЧЕТ СОДЕРЖАНИЯ ХЛОРИДОВ В ПРОБЕ
8.1. Определить значение pCl анализируемого раствора по формуле
, (6)
где E0,1M - потенциал электрода в 0,1 М KCl, мВ;
E1 - потенциал электрода в анализируемом растворе, мВ;
Ke - крутизна электродной функции данного электрода, мВ/pCl.
8.2. Получив значение pCl, найти по табл.5 содержание хлоридов C1 (мкг/дм3) и с учетом разбавления определить концентрацию Cl в анализируемом растворе.
В данном случае кратность разбавления (r) равна 2,5. Объем добавляемого буферного раствора не принимается во внимание при учете разбавления, так как он и не учитывается при определении потенциала электрода стандартных растворов для определения электродной функции.
CCl = C1 · r, (7)
где C1 - концентрация хлоридов, найденная по табл.5, мкг/дм3;
r - кратность разбавления.
8.3. Для определения концентрации хлоридов вместо расчета по формуле можно пользоваться калибровочным графиком. Для этого необходимо определить потенциалы электрода в стандартных растворах с известной концентрацией хлоридов. По результатам измерений построить график lg CCl = f (E).
Таблица 5
Пересчет pCl в массовую концентрацию хлоридов
pCl | C1 мкг/дм3 | |
4,00 | 3550,00 | |
3,99 | 3632,69 | |
3,98 | 3717,31 | |
3,97 | 3803,89 | |
3,96 | 3892,50 | |
3,95 | 3983,17 | |
3,94 | 4075,95 | |
3,93 | 4170,89 | |
3,92 | 4268,04 | |
3,91 | 4367,45 | |
3,90 | 4469,19 | |
3,89 | 4573,29 | |
3,88 | 4679,81 | |
3,87 | 4788,82 | |
3,86 | 4900,36 | |
3,85 | 5014,51 | |
3,84 | 5131,31 | |
3,83 | 5250,83 | |
3,82 | 5373,14 | |
3,81 | 5498,30 | |
3,80 | 5626,37 | |
3,79 | 5757,43 | |
3,78 | 5891,53 | |
3,77 | 6028,76 | |
3,76 | 6169,19 | |
3,75 | 6312,89 | |
3,74 | 6459,94 | |
3,73 | 6610,41 | |
3,72 | 6764,39 | |
3,71 | 6921,95 | |
3,70 | 7083,18 | |
3,69 | 7248,17 | |
3,68 | 7417,04 | |
3,67 | 7589,77 | |
3,66 | 7766,55 | |
3,65 | 7947,46 | |
3,64 | 8132,58 | |
3,63 | 8322,01 | |
3,62 | 8515,86 | |
3,61 | 8714,22 | |
3,60 | 8917,20 | |
3,59 | 9124,91 | |
3,58 | 9337,45 | |
3,57 | 9554,95 | |
3,56 | 9777,51 | |
3,55 | 10005,26 | |
3,54 | 10238,31 | |
3,53 | 10476,79 | |
3,52 | 10720,83 | |
3,51 | 10970,55 | |
3,50 | 11226,09 | |
3,49 | 11487,57 | |
3,48 | 11755,15 | |
3,47 | 12028,97 | |
3,46 | 12309,16 | |
3,45 | 12595,88 | |
3,44 | 12889,27 | |
3,43 | 13189,50 | |
3,42 | 13496,72 | |
3,41 | 13811,10 | |
3,40 | 14132,80 | |
3,39 | 14462,00 | |
3,38 | 14798,86 | |
3,37 | 15143,57 | |
3,36 | 15496,31 | |
3,35 | 15857,27 | |
3,34 | 16226,63 | |
3,33 | 16604,60 | |
3,32 | 16991,37 | |
3,31 | 17387,15 | |
3,30 | 17792,15 | |
3,29 | 18206,58 | |
3,28 | 18630,66 | |
3,27 | 19064,63 | |
3,26 | 19508,70 | |
3,25 | 19963,12 | |
3,24 | 20428,12 | |
3,23 | 20903,95 | |
3,22 | 21390,87 | |
3,21 | 21889,12 | |
3,20 | 22398,99 | |
3,19 | 22920,73 | |
3,18 | 23454,62 | |
3,17 | 24000,95 | |
3,16 | 24560,00 | |
3,15 | 25132,08 | |
3,14 | 25717,48 | |
3,13 | 26316,51 | |
3,12 | 26929,50 | |
3,11 | 27556,77 | |
3,10 | 28198,65 | |
3,09 | 28855,48 | |
3,08 | 29527,61 | |
3,07 | 30215,40 | |
3,06 | 30919,21 | |
3,05 | 31639,41 | |
3,04 | 32376,38 | |
3,03 | 33130,53 | |
3,02 | 33902,24 | |
3,01 | 34691,92 | |
3,00 | 35500,00 | |
2,99 | 36326,90 | |
2,98 | 37173,06 | |
2,97 | 38038,94 | |
2,96 | 38924,98 | |
2,95 | 39831,66 | |
2,94 | 40759,45 | |
2,93 | 41708,86 | |
2,92 | 42680,39 | |
2,91 | 43674,54 | |
2,90 | 44691,85 | |
2,89 | 45732,86 | |
2,88 | 46798,11 | |
2,87 | 47888,18 | |
2,86 | 49003,64 | |
2,85 | 50145,08 | |
2,84 | 51313,11 | |
2,83 | 52508,35 | |
2,82 | 53731,42 | |
2,81 | 54982,99 | |
2,80 | 56263,71 | |
2,79 | 57574,26 | |
2,78 | 58915,34 | |
2,77 | 60287,65 | |
2,76 | 61691,93 | |
2,75 | 63128,92 | |
2,74 | 64599,38 | |
2,73 | 66104,09 | |
2,72 | 67643,86 | |
2,71 | 69219,48 | |
2,70 | 70831,81 | |
2,69 | 72481,70 | |
2,68 | 74170,01 | |
2,67 | 75897,65 | |
2,66 | 77665,54 | |
2,65 | 79474,60 | |
2,64 | 81325,80 | |
2,63 | 83220,12 | |
2,62 | 85158,57 | |
2,61 | 87142,17 | |
2,60 | 89171,97 | |
2,59 | 91249,05 | |
2,58 | 93374,51 | |
2,57 | 95549,49 | |
2,56 | 97775,12 | |
2,55 | 100052,59 | |
2,54 | 102383,12 | |
2,53 | 104767,93 | |
2,52 | 107208,29 | |
2,51 | 109705,49 | |
2,50 | 112260,86 | |
2,49 | 114875,75 | |
2,48 | 117551,55 | |
2,47 | 120289,68 | |
2,46 | 123091,50 | |
2,45 | 125958,75 | |
2,44 | 128892,71 | |
2,43 | 131895,01 | |
2,42 | 134967,24 | |
2,41 | 138111,03 | |
2,40 | 141328,05 | |
2,39 | 144620,00 | |
2,38 | 147988,63 | |
2,37 | 151435,73 | |
2,36 | 154963,12 | |
2,35 | 158572,68 | |
2,34 | 162266,31 | |
2,33 | 166045,98 | |
2,32 | 169913,68 | |
2,31 | 173871,48 | |
2,30 | 177921,47 | |
2,29 | 182065,79 | |
2,28 | 186306,65 | |
2,27 | 190646,29 | |
2,26 | 195087,01 | |
2,25 | 199631,17 | |
2,24 | 204281,18 | |
2,23 | 209039,50 | |
2,22 | 213908,65 | |
2,21 | 218891,23 | |
2,20 | 223989,86 | |
2,19 | 229207,25 | |
2,18 | 234546,17 | |
2,17 | 240009,46 | |
2,16 | 245599,99 | |
2,15 | 251320,75 | |
2,14 | 257174,77 | |
2,13 | 263165,14 | |
2,12 | 269295,04 | |
2,11 | 275567,73 | |
2,10 | 281986,52 | |
2,09 | 288554,83 | |
2,08 | 295276,14 | |
2,07 | 302154,00 | |
2,06 | 309192,07 | |
2,05 | 316394,08 | |
2,04 | 323763,85 | |
2,03 | 331305,28 | |
2,02 | 339022,37 | |
2,01 | 346919,21 | |
2,00 | 355000,00 | |
1,99 | 363269,01 | |
1,98 | 371730,63 | |
1,97 | 380389,35 | |
1,96 | 389249,76 | |
1,95 | 398316,55 | |
1,94 | 407594,54 | |
1,93 | 417088,63 | |
1,92 | 426803,87 | |
1,91 | 436745,41 | |
1,90 | 446918,52 | |
1,89 | 457328,59 | |
1,88 | 467981,14 | |
1,87 | 478881,82 | |
1,86 | 490036,41 | |
1,85 | 501450,83 | |
1,84 | 513131,12 | |
1,83 | 525083,48 | |
1,82 | 537314,24 | |
1,81 | 549829,90 | |
1,80 | 562637,08 | |
1,79 | 575742,58 | |
1,78 | 589153,35 | |
1,77 | 602876,50 | |
1,76 | 616919,29 | |
1,75 | 631289,19 | |
1,74 | 645993,80 | |
1,73 | 661040,93 | |
1,72 | 676438,55 | |
1,71 | 692194,83 | |
1,70 | 708318,12 | |
1,69 | 724816,97 | |
1,68 | 741700,13 | |
1,67 | 758976,54 | |
1,66 | 776655,38 | |
1,65 | 794746,00 | |
1,64 | 813258,02 | |
1,63 | 832201,23 | |
1,62 | 851585,69 | |
1,61 | 871421,67 | |
1,60 | 891719,68 | |
1,59 | 912490,50 | |
1,58 | 933745,14 | |
1,57 | 955494,86 | |
1,56 | 977751,19 | |
1,55 | 1000525,94 | |
1,54 | 1023831,18 | |
1,53 | 1047679,28 | |
1,52 | 1072082,86 | |
1,51 | 1097054,88 | |
1,50 | 1122608,57 | |
1,49 | 1148757,48 | |
1,48 | 1175515,48 | |
1,47 | 1202896,75 | |
1,46 | 1230915,82 | |
1,45 | 1259587,53 | |
1,44 | 1288927,09 | |
1,43 | 1318950,06 | |
1,42 | 1349672,36 | |
1,41 | 1381110,26 | |
1,40 | 1413280,46 | |
1,39 | 1446199,99 | |
1,38 | 1479886,31 | |
1,37 | 1514357,29 | |
1,36 | 1549631,20 | |
1,35 | 1585726,75 | |
1,34 | 1622663,07 | |
1,33 | 1660459,75 | |
1,32 | 1699136,83 | |
1,31 | 1738714,81 | |
1,30 | 1779214,68 | |
1,29 | 1820657,91 | |
1,28 | 1863066,48 | |
1,27 | 1906462,88 | |
1,26 | 1950870,10 | |
1,25 | 1996311,70 | |
1,24 | 2042811,78 | |
1,23 | 2090394,98 | |
1,22 | 2139086,53 | |
1,21 | 2188912,26 | |
1,20 | 2239898,57 | |
1,19 | 2292072,51 | |
1,18 | 2345461,74 | |
1,17 | 2400094,56 | |
1,16 | 2455999,95 | |
1,15 | 2513207,53 | |
1,14 | 2571747,66 | |
1,13 | 2631651,36 | |
1,12 | 2692950,39 | |
1,11 | 2755677,26 | |
1,10 | 2819865,23 | |
1,09 | 2885548,33 | |
1,08 | 2952761,39 | |
1,07 | 3021540,04 | |
1,06 | 3091920,74 | |
1,05 | 3163940,83 | |
1,04 | 3237638,48 | |
1,03 | 3313052,77 | |
1,02 | 3390223,68 | |
1,01 | 3469192,13 | |
1,00 | 3550000,00 | |
9. ОБРАБОТКА РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ ПРИ ОПРЕДЕЛЕНИИ СОДЕРЖАНИЯ ХЛОРИДОВ
9.1. Экспериментальные исследования проводятся для расчета погрешности определения содержания хлоридов в заданном диапазоне концентраций (3,55·103-3,55·106) мкг/дм3.
9.2. Доверительную вероятность при проведении экспериментальных исследований принимаем равной 0,8 (P = 0,8).
9.3. Количество наблюдений (определений) n содержания хлоридов для каждой концентрации определяют по формуле
. (8)
При P = 0,8 n = 10.
9.4. Оценку погрешности определения концентрации хлоридов проводят в такой последовательности:
9.4.1. Определяют систематическую составляющую погрешности по формуле
мкг/дм3, (9)
где Ci - значения концентрации хлоридов при i-м определении;
Cд - действительное значение концентрации хлоридов.
9.4.2. Определяют среднеквадратическое отклонение случайной составляющей погрешности по формуле
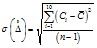
где - среднее значение результатов наблюдений (концентрации) содержания хлоридов, определяемое по формуле
мкг/дм3. (11)
9.4.3. Определяют границы, в которых с вероятностью P = 0,8 находится погрешность определения концентрации по формуле
мкг/дм3, (12)
где Δl(h) - нижняя (верхняя) граница погрешности;
tp - коэффициент, зависящий от заданной вероятности и числа наблюдений: при P = 0,8 и n = 10 tp = 1,372.
9.4.4. Находят границы, в которых с вероятностью P = 0,8 находится результат определения концентрации по формулам:
Cl = Cд + Δl мкг/дм3;
(13)
Ch = Cд + Δh мкг/дм3,
где Cl - нижняя граница;
Ch - верхняя граница.
10. НОРМЫ ПОГРЕШНОСТИ. ФОРМЫ ПРЕДСТАВЛЕНИЯ РЕЗУЛЬТАТОВ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ХЛОРИДОВ
10.1. В нормативно-технической документации не установлены нормы погрешности определения содержания хлоридов в электролите электролизных установок.
10.2. Результаты, согласно "Методическим указаниям. Государственная система обеспечения единства измерений. Результаты и характеристики погрешности измерений. Формы представления. Способы использования при испытаниях образцов продукции и контроле их параметров: МИ 1317-86". (М.: Издательство стандартов, 1986), представлены в следующей форме:
Cl, Ch, P.
10.3. Результаты определения содержания хлоридов для различных концентраций с доверительной вероятностью P = 0,8 находятся по табл.6.
Таблица 6
Результаты определения содержания хлоридов для различных концентраций
Диапазон измерений, мкг/дм3 | Результат определения, мкг/дм3 | |
Нижняя граница (наименьшее значение) | Верхняя граница (наибольшее значение) | |
3,55·103÷-3,55·106 | Cl = 83 + 0,95 · Cизм | Ch = 1,01 · Cизм |
Примечание. Cизм - значение концентрации хлоридов, определенное по табл.5. | ||
10.4. Пример определения концентрации хлоридов.
10.4.1. Показания иономера в анализируемом растворе E = -218 мВ.
10.4.2. По формуле (6) при K1 =57 и E0,1M = -100 мВ получим pCl =3,07.
10.4.3. По табл.5 находим Cизм = 30215,4 мкг/дм3.
10.4.4. Определяем нижнюю и верхнюю границы концентрации хлоридов по табл.6:
Cl = -83+0,95·30215,4=28621,6;
Ch = 1,01·30215,4=30517,6.
Таким образом, результат определения концентрации хлоридов находится в границах от 28621,6 до 30517,6 мкг/дм3.