МУК 4.2.796-99
Утверждаю
Первый заместитель Министра здравоохранения Российской Федерации, Главный государственный санитарный врач Российской Федерации
Г.Г.Онищенко
22.12.99 г.
Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы санитарно-паразитологических исследований
Методические указания
МУК 4.2.796-99
Дата введения: 22 марта 2000 года
1. Подготовлены авторским коллективом в составе: д.м.н. Романенко Н.А., к.б.н. Семенова Т.А., к.м.н. Новосильцев Г.И., Мусыргалина Ф.Ф., Сабгайда Т.П., Байрамгулова Г.Р. (ИМПиТМ им. Е.И.Марциновского МЗ РФ), д.б.н. Беэр С.А. (Институт паразитологии РАН), к.м.н. Хроменкова Е.П., к.м.н. Димидова Л.Л., к.м.н. Гримайло Л.В. (Ростовский НИИ гигиены и паразитологии), к.б.н. Чернышова Л.Г. (ХабНИИЭМ), д.б.н. Скрипова Л.В. (БелНИИЭМ), к.б.н, Козырева Т.Г. (ЦГСЭН в Хабаровском крае), Тимошенко Н.И., Гороненкова О.Н., Кузнецова К.Ю., Пирожкова А.А. (ЦГСЭН г. Москвы), д.м.н. Чебышев Н.В., к.б.н. Черникова Е.А., к.б.н. Макарова Т.Ю. (ММА им. И.М.Сеченова), к.м.н. Евдокимов В.И., к.м.н. Землянский О.А., Евдокимов В.В., Феттер В.В. (ЦГСЭН в Белгородской области), Сыскова Т.Г., к.б.н. Цыбина Т.Н. (ФЦ ГСЭН РФ), к.м.н. Гузеева Т.М. (ЦГСЭН в Нижневартовском районе), д.в.н. Черепанов А.А., Григорьев А.Г., Пирова Л.А., д.б.н. Горохов В.В., Воличев А.Н. (ВИГИС), д.м.н. Локтева И.М., д.м.н. Падченко И.К., Павликовская Т.Н., Кладова Л.А., Гораш В.Р. (НИИЭиИБ им. Л.В.Громашевского).
2. Утверждены Главным государственным санитарным врачом Российской Федерации 22 декабря 1999 года. Введены в действие 22 марта 2000 года.
3. Введены взамен "Методических указаний по гельминтологическому исследованию объектов внешней среды и санитарным мероприятиям по охране от загрязнения яйцами гельминтов и обезвреживанию от них нечистот, почвы, овощей, ягод, предметов обихода" 1440-76 от 14 июня 1976 г.
1. Назначение и область применения
1.1. Настоящие методические указания устанавливают методы лабораторного контроля за объектами окружающей среды (почва, сточные воды, их осадки, навоз и навозные стоки, предметы обихода, природная и питьевая вода и т.п.), санитарным состоянием коммунальных, сельскохозяйственных, пищевых, торговых предприятий, детских школьных, дошкольных и других учреждений, а также для проведения сертификационных испытаний приборов, установок отечественного и импортного производства (например, биотуалеты, водоочистные устройства индивидуального и коллективного пользования и др.) по паразитологическим показателям.
1.2. Методические указания предназначены для применения в аккредитованных паразитологических производственных, испытательных лабораториях и лабораториях учреждений Государственной санитарно-эпидемиологической службы Российской Федерации, осуществляющих санитарно-паразитологический контроль качества окружающей среды на соответствие СанПиН 3.2.569-96 "Профилактика паразитарных болезней на территории Российской Федерации", а также научных учреждений, занимающихся изучением особенностей эпидемиологии паразитарных болезней и научно обосновывающих мероприятиях по охране окружающей среды от загрязнения и защите здоровья населения.
2. Нормативные ссылки
2.1. Федеральный закон "О санитарно-эпидемиологическом благополучии населения" от 30 марта 1999 г. № 52-ФЗ.
2.2. Положение о государственном санитарно-эпидемиологическом нормировании, утвержденное Постановлением Правительства Российской Федерации от 5 июня 1994 г. № 625 с изменениями и дополнениями к нему, утвержденными Постановлением Правительства Российской Федерации от 30 июня 1998 г. № 680.
2.3. Положение о государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное Постановлением Правительства Российской Федерации от 30 июня 1998 г. № 680.
2.4. СанПиН 3.2.563-96 "Профилактика паразитарных болезней на территории Российской Федерации".
3. Санитарно-паразитологический контроль
за объектами окружающей среды
Выбор эпидемически значимых факторов окружающей среды при проведении лабораторного санитарно-паразитологического надзора за объектами хозяйственно-бытовой и производственной деятельности человека в каждом конкретном случае проводит врач-паразитолог, а при его отсутствии - врач-эпидемиолог совместно с санитарными врачами ЦГСЭН.
Исследуемый материал, объемы и кратность отбираемых врачом-лаборантом или лаборантом проб на контролируемых объектах представлен в табл. 1.
По эпидемической значимости объекты хозяйственно-бытовой и производственной деятельности человека делятся на 3 категории:
1. Предприятия общественного питания, пищеблоки в детских дошкольных учреждениях (ДДУ), школах, больницах, домах инвалидов, престарелых, детских домах и домах ребенка, сооружения питьевого водоснабжения населения и др. (в табл. 1 отмечены знаком ++).
На данных объектах нарушение санитарно-эпидемиологичес-кого режима непроизвольно приведет к заражению человека (через пищу, воду и т. п.) возбудителями гельминтозов и (или) кишечных протозоозов, поэтому санитарно-паразитологический надзор за ними должен быть наиболее тщательным и строгим.
2. Теплицы, рыборазводные хозяйства, предприятия торговли и др. (в табл. 1 помечены знаком +) не менее опасны в эпидемическом отношении, но при строгом соблюдении правил личной и общей гигиены, технологических приемов (мытье рук, овощей, фруктов, столовой зелени, термическая обработка рыбы, мяса и т.д.) можно резко снизить или исключить риск заражения возбудителями паразитарных болезней. Лабораторный контроль за соблюдением санитарно-эпидемиологического режима на объектах 2 категории должен быть не менее строгим, чем на объектах 1 категории.
3. Поля орошения, очистные сооружения канализации и др. объекты (в таблице 1 - без пометки) с меньшим риском заражения человека должны также подвергаться лабораторному санитарно-паразитологическому надзору даже при строгом соблюдении на них санитарного режима и правил личной гигиены.
В каждой категории указанных объектов имеются предметы (среда), которые в обязательном порядке должны исследоваться на наличие яиц гельминтов и цист кишечных патогенных простейших. Обнаружение на (в) них возбудителей паразитарных болезней объективно свидетельствует о нарушении санитарно-эпидемиологического режима (табл. 1, графа 3).
Таблица 1
Санитарно-паразитологические исследования на объектах хозяйственно-бытовой и производственной деятельности человека
№ п/п | Объекты надзора | Исследуемый материал и места отбора проб | Кратность исследований | Число отбираемых проб |
1 | 2 | 3 | 4 | 5 |
1 | Пищеблоки ++ ДДУ, школ, школ-интернатов, детских домов, домов и баз отдыха, санаториев, летних оздоровительных учреждений, кафе, ресторанов, столовых, лечебных учреждении | Смывы с разделочных столов, досок, рук персонала, ручек дверей, посуды, ложек, вилок, ножей, овощей, фруктов, ягод, столовой зелени, кранов и бачков для питьевой воды | 2 раза в год | 20 - 30 |
2 | Залы для приема пищи ++ в тех же учреждениях | Смывы с клеенок, скатертей обеденных столов, посуды, рук официантов, полотенец | 2 раза в год | 20 - 30 |
3 | Мясокомбинаты ++ | Смывы со столов для готовой продукции, рук персонала, спецодежды, рабочего инвентаря | 2 раза в год | 20 - 30 |
4 | Предприятия торговли пищевыми продуктами ++ | Смывы с прилавков, стеллажей, рук продавцов, весов, столов в комнатах приема пищи, водопроводных кранов или кранов бачков для хранения питьевой воды, спецодежды | 2 раза в год | 20 - 30 |
|
| Овощи, фрукты, ягоды, столовая зелень | 2 раза в год По эпид. показаниям, до реализации населению | 2 2 |
5 | Очистные станции централизованных систем питьевого водоснабжения | Вода на входе на станцию и выходе из распределительной сети | В соответствии с информационно - методическим | 2 |
| ++ | Вода из водовозок | письмом по контролю качества питьевой воды № 1100/1670-98-111 от 24.07.98 | 2 |
6 | Тепличные хозяйства + | Почва с поверхности и глубины до 20 см | Вновь завозимая, после внесения органических удобрений, остальная - 1 раз в год | 2 - 3 |
|
| Вода, используемая для поливов выращиваемых культур | Во время поливов | 2 - 3 |
|
| Овощи, столовая зелень | 2 раза: в период выращивания и сбора урожая | 2 - 3 |
|
| Смывы с рук и спецодежды персонала, столов в комнате для приема пищи | 2 раза в год | 20 - 30 |
7 | Оросительные системы с использованием сточных вод, их осадков, животноводческих стоков + | Почва с поверхности и глубины до 20 см, до и после внесения жидких и твердых органических удобрений | 2 раза в год | 2 - 3 |
|
| Сточные воды, их осадки, животноводческие стоки, используемые в качестве удобрений | 2 раза в год | 2 - 3 |
|
| Многолетние или однолетние травы, технические и кормовые культуры | 2 раза в год | 2 - 3 |
|
| Грунтовые воды по ходу грунтового потока: на уровне, выше и ниже (500 м) полей орошения | 2 раза в год | 2 - 3 |
|
| Смывы с рук и спецодежды персонала, мебели в комнатах отдыха и приема пищи | 2 раза в год | 20 - 30 |
8 | Очистные сооружения канализации +: сооружения механической | Сточная вода на входе и выходе из очистных сооружений | 2 раза в год | 2 - 3 |
| очистки, аэро- и биостанции, малогабаритные (компактные) очистные | Вода из поверхностных водоемов: в местах сброса сточных вод, выше и ниже них (500 м) | 2 раза в год | 2 - 3 |
| сооружения, биологические пруды и др. | Осадки сточных вод из первичных и вторичных отстойников, с иловых площадок, после обеззараживания | 2 раза в год | 2 - 3 |
Смывы с рук и спецодежды персонала, мебели в комнатах отдыха и приема пищи | 2 раза в год | 20 - 30 | ||
9 | Животноводческие хозяйства + | Смывы с мебели комнат отдыха и приема пищи, рук и спецодежды персонала, дверных ручек, подсобных помещений | 1 раз в год | 20 - 30 |
|
| Животноводческие стоки на входе и выходе из очистных сооружений | 1 раз в год | 2 - 3 |
10 | Бани, плавательные бассейны + | Вода. В банях - холодная вода, в бассейнах - вода из ванн | 1 раз в квартал | 2 - 3 |
|
| Смывы с рук и спецодежды персонала, скамеек в раздевалках, столов, кресел, обходных дорожек, дверных ручек и поручней | 1 раз в квартал | 20 - 30 |
11 | Детские учреждения +: ДДУ, школы, школы-интернаты, детские дома, детские отделения больниц, летние оздоровительные и спортивные лагеря | Смывы с рук детей и персонала, спецодежды, постельного и нательного белья, игрушек, парт, столов, учебных принадлежностей, спортивного инвентаря, ручек дверей спален, палат, игровых и туалетных комнат, водопроводных кранов, стульчаков, скамеек | 2 раза в год | 20 - 30 |
|
| Почва с поверхности игровых площадок, у входа и вокруг помещений, вдоль заборов, около веранд, вокруг наружных санузлов, школьных огородов | 2 раза в год | 2 - 3 |
|
| Песок в песочницах | 2 раза в год | 1 - 2 |
12 | Детские игровые площадки + в парках, скверах, во дворах коммунальных домовладений и т. п. | Почва с поверхности | 1 раз в год | 2 - 3 |
|
| Песок | 1 раз в год | 1 - 2 |
|
| Смывы со скамеек, горок, качелей, бревен, лестничной стенки, ручек игровых принадлежностей | 1 раз в год | 20 - 30 |
13 | Дома для инвалидов и престарелых | Смывы в палатах, туалетных комнатах, пищеблоках, с рук персонала | 2 раза в год | 20 - 30 |
14 | Детские приемники-распределители | Смывы в палатах, учебных и игровых комнатах, туалетах, пищеблоках, с рук персонала | 2 раза в год | 20 - 30 |
15 | Исправительно-трудовые учреждения | Смывы в камерах, в помещениях трудовой деятельности, комнатах отдыха, туалетах, пищеблоках, с рук персонала | 2 раза в год | 20 - 30 |
16 | Транспорт: железнодорожный, водный, воздушный и автотранспорт | Смывы с рук и спецодежды проводников, бортпроводниц, кресел, постельных принадлежностей, ручек дверей | 1 раз в год | 20 - 30 |
17 | Мастерские по выделке шкур и ателье по пошиву меховых изделий | Смывы с рук и спецодежды персонала, шкур, меховых изделий, разделочного инвентаря, мебели в комнатах отдыха и приема пищи | 1 раз в год | 20 - 30 |
18 | Территория населенных пунктов | Почва с территории улиц, дворов индивидуальных, фермерских и коммунальных домовладений, вокруг магазинов, с площадок для выгула собак, спортивных сооружений, рекреационных зон | 1 раз в год | 8 - 10 |
19 | Территории, отводимые под строительство объектов пищевого, культурного, спортивного назначения (баз, складов, магазинов, скверов, детских площадок) | Почва | Во время отвода участков | 10 - 15 |
4. Оценка результатов санитарно-паразитологических
исследований
При проведении санитарно-паразитологических исследований масса объединенной пробы почвы должна составлять 200 г; донных отложений - 200 г; питьевой воды - 50 л; природной воды - 25 л; поверхностных стоков - 1 л; неочищенных (до поступления на очистные сооружения) сточных вод или животноводческих стоков - 1 л; после сооружений механической очистки - 3 л; после вторичных отстойников, биологических прудов, полей фильтрации - 10 л; осадков сточных вод 98% влажности - 1 л; обезвоженных осадков сточных вод и навоза - 200 г.
Смывы на пробу берут с площади 0,25 м2 (0,5 х 0,5 м) или с 10 тарелок, кукол, ручек дверей.
Отбор пробы пыли пылесосом проводится с поверхности площадью 0,25 м2, время отбора 20 сек.
В заключении о санитарном состоянии объекта указывают общее количество исследованных проб, число положительных из них и число обнаруженных яиц гельминтов и цист кишечных патогенных простейших по видам.
Количество жизнеспособных возбудителей паразитарных болезней определяют при просмотре их значительного (не менее 100) числа, а затем вычисляют удельный вес; если найдены единичные яйца гельминтов и цисты кишечных патогенных простейших, приводят их абсолютные числа.
Результаты анализа вносят в "Журнал регистрации санитарно-паразитологических исследований" (форма 373"у"), в котором отражают место отбора, даты отбора и исследования проб, метод исследования, количество исследуемого материала (в граммах или литрах), результаты (всего обнаружено возбудителей паразитов, в т.ч. яиц гельминтов, цист кишечных патогенных простейших), в среднем на 1 кг/л или 1 дм3 площади.
О санитарно-гигиеническом состоянии объектов окружающей среды судят по наличию или отсутствию на (в) них возбудителей паразитарных болезней.
В соответствии с СанПиНом 3.2.569-96 "Профилактика паразитарных болезней на территории Российской Федерации" вода питьевая, рекреационные воды, почва селитебных территорий, населенных пунктов, сельскохозяйственных полей, фермерских, крестьянских, а также тепличных хозяйств, сточные воды, их осадки и животноводческие стоки, сбрасываемые в поверхностные водоемы, не должны содержать жизнеспособных яиц гельминтов и цист кишечных патогенных простейших.
Возбудители паразитарных болезней не должны обнаруживаться на ночных горшках, детских полотенцах, игрушках, посуде, клеенках на столах, руках детей и персонала, разделочном инвентаре пищеблоков, ручках дверей, нательном и постельном белье. Обнаружение даже единичных яиц гельминтов и цист кишечных патогенных простейших на указанных предметах свидетельствуют о нарушении санитарно-эпидемиологического режима в обследуемых объектах.
5. Оборудование для санитарно-паразитологических лабораторий
5.1. Аппаратура, инструментарий, оптика
5.1.1. Шкаф вытяжной.
5.1.2. Холодильник электрический бытовой.
5.1.3. Термостат электрический (ТС-80 или аналогичный).
5.1.4. Центрифуги напольные (типа ОПН-3, ОПН-8, ЦЛС-31М со сменным ротором).
5.1.5. Микроскоп "БИОЛАМ" или "БИМАМ", микроскоп стереоскопический (типа МБС).
5.1.6. Осветитель к микроскопу ОИ-19 или другой аналогичный.
5.1.7. Столик нагревательный к микроскопу.
5.1.8. Весы лабораторные общего назначения 4-го класса точности, максимальный предел взвешивания 200 г.
5.1.9. Весы лабораторные общего назначения 4-го класса точности, максимальный предел взвешивания 1 кг.
5.1.10. Пинцеты анатомические.
5.1.11. Кисти мягкие (из волоса белки, колонка или соболя) для живописи №№ 12 - 18.
5.1.12. Штативы лабораторные для пробирок (ТУ 61-1-707-80).
5.1.13. Иглы препаровальные.
5.1.14. Совки, шпатели, ложки, лопаты, бур Некрасова.
5.1.15. Пластиковые мешки и пакеты.
5.1.16. Щюттель-аппарат.
5.1.17. Аппарат Гольдмана.
5.1.18. Насос Камовского, водоструйный насос.
5.1.19. Приборы вакуумного фильтрования ПВФ-142/Э и ПВФ-142/ЭМ.
5.1.20. Мембранные фильтры с размером пор 1 - 4 мкм и диаметром мембранного диска, соответствующим размерам фильтродер-жателя фильтровального устройства (фирм "Владипор", "Сарториус", "Миллипор", "Прагопор").
5.1.21. Пылесос, электрощетка.
5.1.22. Ситечки с металлической или капроновой сеткой (размер ячеек 0,25 - 0,3 мм).
5.1.23. Резиновые груши разных размеров.
5.1.24. Скальпели анатомические.
5.1.25. Ножницы анатомические разных размеров.
5.1.26. Счетная камера (для количественного учета яиц гельминтов).
5.1.27. Карандаш по стеклу.
5.1.28. Лейкопластырь.
5.1.29. Скотч.
5.1.30. Клеенка.
5.1.31. Фартук клеенчатый.
5.1.32. Перчатки резиновые.
5.1.33. Весы для уравновешивания центрифужных пробирок.
5.1.34. Кюветы эмалированные.
5.1.35. Кюветы почкообразные.
5.1.36. Корнцанги.
5.1.37. Пинцеты глазные.
5.1.38. Штатив Бунзена.
5.1.39. Треножник.
5.1.40. Горелки газовые.
5.1.41. Трубки резиновые.
5.1.42. Сложная петля.
5.1.43. Поплин, перкаль, сатин.
5.1.44. Лопаты.
5.1.45. Ножи почвенные.
5.1.46. Сита почвенные с сеткой 0,25; 0,5; 1; 3 мм.
5.1.47. Шпатели металлические.
5.1.48. Шпатели пластмассовые.
5.1.49. Калька.
5.1.50. Пергамент.
5.1.51. Коробки картонные.
5.1.52. Аппарат Бермана.
5.1.53. Термовлагобарометр БМ-2.
5.2. Стеклоизделия
5.2.1. Стаканы стеклянные высокие с носиком (ВН) номинальной вместимостью 50 - 100 мл (ГОСТ 10394-63).
5.2.2. Пробирки центрифужные градуированные (ПЦГ) емкостью 10 мл (ГОСТ 1770-64), 50,100 и 250 мл.
5.2.3. Стекла предметные размерами 25 х 75 мм; 60 х 120 мм.
5.2.4. Стекла покровные размерами 18 х 18; 24 х 24 мм (ГОСТ 6672-99).
5.2.5. Чашки биологические (Петри) (ГОСТ 25336-82).
5.2.6. Часы песочные на 3 - 5 мин., или часы сигнальные.
5.2.7. Емкости для отбора проб воды, осадков, навоза и навозных стоков из нейтрального материала, пригодные для обеззараживания принятыми методами: канистры пластмассовые емкостью 1; 2; 5; 20 и 25 л; стеклянные бутылки; фляги металлические емкостью 30 - 35 л; эмалированные бидоны; ведра 8 - 10 л; тазы.
5.2.8. Цилиндры измерительные с носиком 1-00, 1-25, 1-500 (ГОСТ 1770-74).
5.2.9. Колбы 2-50-2, 2-100-2, 1-1000 (ГОСТ 1770-74).
5.2.10. Капельница для многократной дозировки по Манну (ГОСТ 9876-61).
5.2.11. Широкогорлые стеклянные или пластиковые флаконы емкостью 100; 500; 1000; 2000 мл с притертыми или завинчивающимися крышками.
5.2.12. Спиртовки лабораторные стеклянные.
5.2.13. Денсиметры (ареометры типа I (A1) с пределами измерения от 1,000 до 1,600 кг/м3 (ГОСТ 1300-74).
5.2.14. Дозаторы пипеточные П1-0,1; П1-0,5; П1-1,0 мл (ТУ 64-339-81).
5.2.15. Цилиндры градуированные с носиком на 1,5 - 2,0 л.
5.2.16. Стеклянные воронки разных размеров.
5.2.17. Часовые стекла разных размеров.
5.2.18. Стеклянные палочки.
5.2.19. Пипетки градуированные от 1 до 10 мл.
5.2.20. Банки стеклянные с притертыми или резиновыми пробками разных размеров до 500 мл.
5.2.21. Банки стеклянные широкогорлые до 2 л.
5.2.22. Банки фарфоровые без крышек 500 мл.
5.2.23. Бутыли (1 - 5 л) с тубусом для дезинфицирующих растворов.
5.2.24. Пробирки химические.
5.2.25. Кружки фарфоровые с ручками разных размеров.
5.2.26. Ступки и пестики фарфоровые разных размеров.
5.2.27. Мензурки на 100; 250; 500; 1000 мл.
5.2.28. Кристаллизаторы стеклянные.
5.3. Реактивы
5.3.1. Натрий едкий (ГОСТ 4328-66).
5.3.2. Нитрат натрия, ч.д.а.
5.3.3. Нитрат аммония или гранулированная селитра (аммиачная).
5.3.4. Хлорид цинка.
5.3.5. Нитрат свинца.
5.3.6. Формальдегид 40%-ный.
5.3.7. Нитрат калия (калиевая селитра).
5.3.8. Кислота соляная с массовой долей 3%.
5.3.9. Масло касторовое.
5.3.10. Сульфат железа.
5.3.11. Сульфат меди.
5.3.12. Спирт этиловый ректифицированный технический.
5.3.13. Сульфат цинка семиводный (ZnSO4 · 7H2O), х.ч.
5.3.14. Сахароза, ч.д.а.
5.3.15. Сульфат магния (MgSO4), ч.д.а.
5.3.16. Тиосульфат натрия.
5.3.17. Вода дистиллированная.
5.3.18. Натрий хлористый, х.ч. на изотоническом растворе с массовой долей 0,85% (жидкость Барбагалло).
5.3.19. Йод кристаллический, х.ч.
5.3.20. Калий йодистый (KJ), х.ч.
5.3.21. Эозин сухой, х.ч.
5.3.22. Метиленовый синий сухой, х.ч.
5.3.23. Кислота молочная, х.ч.
5.3.24. Панкреатин.
5.3.25. Пепсин (возможен искусственный).
5.3.26. Трипсин.
5.3.27. Натрий двууглекислый, ч.д.а.
5.3.28. Сульфат алюминия.
5.3.29. Хлорное железо.
5.3.30. Хлористоводородная кислота.
5.3.31. Глицерин.
5.3.32. Раствор Люголя.
5.3.33. Эфир.
5.3.34. Ацетон.
5.3.35. Бензол.
5.3.36. Ксилол.
5.3.37. Бриллианткрезилблау синий (1:10000).
5.3.38. Известь хлорная.
5.3.39. Серная кислота.
5.3.40. Калии двуххромовокислый.
5.3.41. Иммерсионное масло.
5.3.42. Хромпик.
5.3.43. Метиленовый синий.
5.3.44. Молочная кислота.
5.3.45. Раствор йода спиртовой 5%-ный.
5.3.46. Толуидиновый синий (1:1000).
5.3.47. Сафранин (1:10000 спирта 10°С).
5.3.48. Индигокармин.
5.3.49. Раствор пирогалловой кислоты 50%.
5.3.50. Нейтральрот (1:1000).
5.3.51. Акридиновый оранжевый.
5.3.52. Корифосфин.
5.3.53. Примулин.
5.3.54. Ауролин.
5.3.55. Сульфат берлерина.
5.3.56. Трипафлавин.
5.3.57. Риванол.
5.3.58. Акрихин.
5.4. Насыщенные растворы
При проведении санитарно-паразитологических исследований используют насыщенные растворы для методов флотации.
Приготовление флотационных растворов
5.4.1. Раствор нитрата натрия с плотностью 1,38 - 1,40 готовят из расчета 1000 г соли на 1 л воды. Соль насыпают в эмалированное ведро с горячей водой порциями при постоянном помешива-нии до полного растворения. Раствор доводят до кипения, пока не появится на его поверхности кристаллическая пленка. Приготовленный раствор после остывания переливают в другие крупные емкости (бутыли). О насыщенности раствора судят по наличию на дне сосудов кристаллов соли или измеряют ареометром его плотность.
5.4.2. Раствор нитрата аммония, или гранулированной аммиачной селитры, с плотностью 1,3 готовят таким же способом, что и предыдущий раствор, но из расчета 1500 г соли на 1 л горячей воды.
5.4.3. Раствор Брудастова: натриевая селитра - 900 г, калиевая селитра - 400 г, вода - 1 л. После подогревания и растворения солей плотность насыщенного раствора - 1,47 - 1,48. Но через 24 часа она снижается до 1,40 - 1,42. Поэтому раствор следует готовить перед проведением исследований.
5.4.4. Раствор тиосульфата натрия (гипосульфита натрия Na2SO3 · 5H2O) плотностью 1,4 готовят из расчета 1750 г вещества на 1 л воды.
Образующийся на дне сосуда осадок используют при следующем приготовлении насыщенного раствора.
6. Основные методы санитарно-паразитологических исследований
6.1. Исследование почвы
Подготовка к отбору проб. Отбор проб для паразитологических анализов проводят не менее 1 раза в год для оценки качественного состояния почв естественного и нарушенного сложения.
Для аналогичных исследований почв детских, лечебно-профилактических учреждений и зон отдыха отбор проб проводят не менее 2 раз в год - весной и осенью.
При изучении динамики самоочищения от яиц гельминтов, цист кишечных простейших отбор проб проводят в течение первого месяца еженедельно, а затем ежемесячно в течение вегетационного периода до завершения активной фазы самоочищения.
Для оценки качества по паразитологическим показателям почв сельскохозяйственных угодий, в зависимости от характера источника загрязнения, возделываемой культуры и рельефа местности на каждые 0,5 - 20,0 га территории закладывают не менее 1 пробной площадки размером 10 х 10 м; на территории расположения детских и лечебно-профилактических учреждений, игровых площадок, выгребов, мусорных ящиков и других объектов, занимающих небольшие площади, размер пробной площадки должен быть не более 5 х 5 м.
Отбор проб почвы. Точечные пробы отбирают в соответствии с МУ 2.1.7.730-99 на модельной площадке из одного или нескольких слоев или горизонтов методом конверта, по диагонали или любым другим способом с таким расчетом, чтобы каждая проба представляла собой часть почвы, типичной для генетических горизонтов или слоев данного типа.
Точечные пробы отбирают ножом, совком или шпателем из прикопок или почвенным буром Некрасова. Объединенную пробу составляют путем смешивания точечных проб, отобранных на одной пробной площадке.
Для паразитологического анализа с каждой пробной площадки берут одну объединенную пробу массой 200 г, составленную из 10 точечных проб массой 20 г каждая, отобранных послойно с поверхности и глубины 10 - 20 см. При необходимости отбор проб проводят из более глубоких (40 - 60 см) слоев почвы послойно. Пробы помещают в банки с крышками или пакеты из клеенки, пластика, этикетируют с указанием места отбора, даты, глубины, характера исследуемого участка (в тени или на солнце, состав почвы, наличие растительности и т.д.). Все объединенные пробы должны быть зарегистрированы в журнале, пронумерованы. В процессе транспортирования и хранения почвенных проб должны быть приняты меры по предупреждению возможности их загрязнения.
Паразитологический анализ проб почвы проводят в день доставки их в лабораторию. При невозможности немедленного проведения исследований пробы почвы хранят в холодильнике при температуре до 5°С. Для исследования на цисты кишечных патогенных простейших почву без обработки хранят не более 2 суток; на яйца биогельминтов - до 7 суток, а на яйца геогельминтов - не более 1 месяца.
Для предотвращения высыхания и развития личинок в яйцах геогельминтов почву увлажняют и аэрируют один раз в неделю, для чего пробы вынимают из холодильника и оставляют на 3 часа при комнатной температуре, увлажняют водой по мере потери влаги и снова помещают для хранения в холодильник. При необходимости хранения проб почвы более месяца применяют консервирующие средства: почву пересыпают в кристаллизатор, заливают раствором формалина с массовой долей 3%, приготовленным на изотоническом растворе натрия хлористого с массовой долей 0,85% (жидкость Барбагалло), или раствором соляной кислоты с массовой долей 3%, а затем ставят в холодильник.
Подготовка проб почвы к анализу. Пробы почвы в лаборатории рассыпают на бумаге или кальке и разминают пестиком крупные комки. Затем из нее выбирают корни растений, камни, насекомых, стекло, уголь, кости животных, друзы гипса, известковые журавчики и др.
Затем почву переносят в ступку, растирают пестиком и просеивают через сито с ячейками диаметром 1 мм.
6.1.1. Метод исследования почвы на яйца гельминтов
по Романенко Н.А. (1996)
Ход исследования. Из объединенной пробы берут 25 г почвы, помещают в центрифужные пробирки объемом 250 мл (в случае отсутствия таковых можно пользоваться пробирками объемом 80 - 100 мл, но помещать в них следует 15 г почвы) и заливают 3%-ным раствором натриевой или калиевой щелочи (в соотношении 1:1). После этого содержимое пробирок тщательно размешивают при помощи электромешалки или стеклянных палочек, отстаивают в течение 20 - 30 мин., и центрифугируют 5 минут при 800 об/мин. Надосадочную жидкость сливают, а почву промывают водой (1 - 5 раз в зависимости от типа почвы: для песчаных и супесчаных - достаточно одной промывки, для глинистых, суглинистых, черноземных - от 2 до 5) до получения прозрачной надосадочной жидкости. После промывки к почве добавляют 150 мл (45 мл в пробирки объемом 100 мл) насыщенного (плотность 1,38 - 1,40) раствора нитрата натрия, тщательно размешивают и центрифугируют. Пробирки устанавливают в штатив, доливают тем же раствором соли до уровня на 2 - 3 мм ниже краев пробирок и накрывают предметными стеклами. Яйца гельминтов всплывают и концентрируются в поверхностной пленке насыщенного раствора. Поэтому очень важно исключить какую-либо потерю ее.
Для этого между краем пробирки и предметным стеклом оставляют пространство шириной не более 10 мм, куда с помощью пипетки вносят насыщенный раствор соли до его соприкосновения с нижней стороной стекла, последнее осторожно передвигают до полного покрытия центрифужной пробирки. Через 20 - 25 минут отстоя стекла снимают, переворачивая нижней поверхностью вверх, а на их место ставят другие (при необходимости и третьи). На предметные стекла наносят несколько капель 30%-ного раствора глицерина и накрывают их покровными стеклами, а затем микроскопируют. Для обнаружения яиц гельминтов препарат просматривают при увеличении в 80, а для определения степени их развития или деформации - в 400 раз.
При необходимости приготовленные препараты можно хранить в холодильнике до 5 - 7 суток. При подсыхании препаратов по краям покровных стекол добавляют несколько капель 30%-ного раствора глицерина.
Эффективность метода колеблется от 59,6 - 83,1%, в среднем - 73,0%.
Для определения истинной обсемененности почвы яйцами аскарид и власоглава необходимо определить ее тип, а затем умножить число обнаруженных яиц гельминтов на коэффициент для этого типа почвы и для данного вида гельминтов (табл. 2).
Таблица 2
Поправочные коэффициенты для определения
истинной обсемененности почв яйцами аскарид и власоглавов
Тип почвы | Яйца геогельминтов | |
| аскарид | власоглавов |
Дерново-подзолистая (супесь) | 1,23 | 1,43 |
Дерново-подзолистая (суглинок) | 1,45 | 1,50 |
Торфяно-глоевые | 1,84 | 2,40 |
Чернозем обыкновенный | 1,60 | 1,85 |
Чернозем типичный | 1,70 | 2,30 |
Чернозем выщелоченный | 1,43 | 2,10 |
Чернозем каштановый (супесь) | 1,28 | 1,95 |
Чернозем каштановый (суглинок) | 1,64 | 2,15 |
Аллювиально-лугово-лесная | 1,37 | 1,65 |
Сероземы | 1,39 | 1,60 |
Черноземная лесная коричневая | 1,49 | 1,71 |
Горная лесная бурая | 1,54 | 1,72 |
Желтоземы | 1,79 | 1,94 |
Для обнаружения в почве яиц гельминтов, имеющих более высокую плотность (яйца описторхисов, клонорхисов), чем яйца аскарид и власоглавов, следует использовать насыщенный раствор хлорида цинка (плотность 1,78); яйца токсокар лучше выявляются при обработке почвы насыщенным раствором сульфата цинка или сульфата магния в смеси с 5%-ным раствором йодата калия.
Примечание: При работе по данной методике необходимо строго соблюдать следующие требования:
1. Обязательность применения обезжиренных предметных стекол.
2. Обязательность контроля плотности насыщенного раствора с помощью ареометра (плотность должна быть не ниже 1,38 - 1,40).
В случае нарушения указанных требований, в первом случае поверхностная пленка с яйцами гельминтов не прилипнет к стеклу, во втором случае скорость всплывания яиц гельминтов замедлится, и в указанные сроки они не достигнут поверхностной пленки.
Для эффективного использования рабочего времени исследователя рекомендуется: во время первого отстаивания смеси "почва с щелочью" проводить подготовку предметных и покровных стекол, запись в журнале; во время второго - "почвы с насыщенным раствором соли" - подготовку рабочего места для микроскопирования, уборку центрифуги и другого лабораторного оборудования.
После окончания проведения анализов использованную посуду (центрифужные пробирки, предметные и покровные стекла, стеклянные палочки) замачивают в стиральном порошке и кипятят 15 - 20 минут, затем моют в чистой воде.
Пробирки хранят в штативах, предметные и покровные стекла в широкогорлых банках с пробками, заполненных смесью Никифорова или нашатырным спиртом. Перед использованием предметные и покровные стекла не вытирают, а подсушивают.
6.1.2. Метод исследования почвы на личинки гельминтов
по Берману
Ход исследования. Из объединенной пробы берут 20 г почвы и помещают на металлическую сетку (или ситечко для молока), которую устанавливают в аппарат Бермана. Последний представляет собой стеклянную воронку (диаметром 10 - 15 см), соединенную при помощи резиновой трубки с узкой пробиркой. Систему устанавливают в штатив, наполняют теплой (температура 45 - 50°С) водой, а затем металлическую сетку с почвой помещают в воронку так, чтобы нижняя часть ее соприкасалась с водой.
Воронку с почвой ставят в термостат при температуре 37°С. Личинки гельминтов, обладая термотропностью, мигрируют из почвы через сито в теплую воду и оседают на дно пробирки. Через 3 - 4 часа осторожно отсоединяют пробирку от воронки, сливают верхний слой жидкости, а осадок переносят на предметное стекло и микроскопируют. Но лучше содержимое пробирки центрифугировать, а после этого исследовать осадок.
Метод Супряги
В химический стаканчик помещают 10 г почвы, заливают теплым (40°С) физраствором так, чтобы он полностью покрывал пробу. Через 20 минут жидкость сливают в чашку Петри и исследуют под бинокулярным микроскопом МБС. По эффективности метод Супряги не уступает методу Бермана.
Для отличия личинок свободноживущих нематод от паразитических применяют метод Корта. Принцип его заключается в воздействии на личинок нематод формалином. При этом личинки свободноживущих нематод погибают быстрее, чем паразитические. Личинки помещают в воду в чашку Петри или на часовое стекло. При добавлении 40%-ного раствора формалина к жидкости с личинками нематод в соотношении 1:5 личинки свободноживущих нематод гибнут через 5 - 8 минут, а паразитические - остаются живыми в течение 15 - 20 минут, но подвижность их замедляется; при добавлении формалина в соотношении 1:25 первые гибнут через 12 минут, тогда как вторые в 95% случаев остаются нормально подвижны.
6.1.3. Метод исследования почвы на цисты кишечных простейших
по Падченко И.К. (1992)
Ход исследования. Из объединенной пробы берут 25 г почвы, помещают в фаянсовую ступку, постепенно добавляют к ней водопроводную воду, тщательно растирают пестиком до гомогенной кашицы и выливают ее в цилиндр емкостью 1 л, предварительно наполненный на 3/4 объема чистой водой. Смеся размешивают стеклянной палочкой и отстаивают в течение 15 минут. Образовавшуюся на поверхности смеси пленку удаляют петлей, а жидкую часть ее отсасывают сифоном в чистый цилиндр. Осадок повторно промывают (не менее 3 раз), собирая промывные воды в одном цилиндре. Промывные воды отстаивают, через 24 часа надосадочную жидкость удаляют сифоном, а осадок исследуют в нативных мазках и окрашенных раствором Люголя препаратах. С этой целью осадок тщательно встряхивают и одну каплю полученной взвеси наносят пастеровской пипеткой не предметное стекло, накрывают покровным стеклом и исследуют под световым микроскопом. Микроскопируют не менее 1 мл осадка с последующим пересчетом на его общий объем. Анализ осадка проводят в течение первых 2 - 3 суток после его получения.
Для того, чтобы осадок длительное время оставался пригодным к исследованию (до 2 месяцев), к нему добавляют консервант, содержащий мертиолят, 40%-ный раствор формалина, спирт этиловый 96° и физиологический раствор (соотношение компонентов в %: мертиолят - 0,0016 - 0,0018, 40%-ный формалин - 4,1 - 4,4; спирт этиловый 96° - 10,4 - 10,9; физиологический раствор - остальное). Консервант добавляют к осадку в соотношении 1:2 и хранят в холодильнике.
Для приготовления мазков каплю исследований смеси осадка с консервантом после встряхивания наносят пипеткой на предметное стекло, смешивают ее с каплей акридинового оранжевого, разведенного 1:500, накрывают покровным стеклом и исследуют под световым или люминисцентным микроскопом, подсчитывают число неокрашенных (живых) и окрашенных (мертвых и дегенерирующих) цист кишечных простейших каждого вида. При изучении исследуемого материала под световым микроскопом жизнеспособные цисты кишечных простейших остаются неокрашенными, а дегенерирующие и мертвые цисты окрашиваются в желтый цвет. Погибшие цисты под люминисцентным микроскопом красные.
6.2. Исследования воды
6.2.1. Методы исследования воды поверхностных водоемов, питьевой воды и воды плавательных бассейнов изложены в методических указаниях (МУК 4.2.668-97) "Санитарно-паразитологическое исследование воды". - М., 1997.
6.2.2. Исследование сточной воды
Отбор проб. Пробы сточных вод отбирают на входе и выходе с очистных сооружений (механическая очистка, аэро- и билстанции, компактные установки, биологические пруды, поля фильтрации), на полях орошения и в местах сброса их в поверхностные водоемы.
Количество сточных вод на одну пробу должно быть не менее: неочищенной (до поступления на очистные сооружения) - 1 л, после сооружений механической очистки - 3 л, в остальных слчаях - 10 л.
Отбор проб сточных вод проводят в резиновых перчатках при помощи емкостей 200 - 500 мл. Отдельные порции сточных вод сливают в широкогорлые пластиковые или стеклянные емкости соответствующего объема.
При определении эффективности работы очистных сооружений по паразитологическим показателям следует строго соблюдать следующее правило: после отбора проб входящей на очистные сооружения сточной воды, последующие пробы отбирают с учетом времени ее нахождения на каждом этапе очистки, т.е. после первичных отстойников - 10,5 часов, хлораторной - через 11 часов.
Пробы этикетируют, регистрируют в журнале и доставляют в лабораторию, где их хранят в прохладном месте не более суток.
6.2.2.1. Метод исследования сточных вод на яйца гельминтов
по Романенко Н.А. (1996)
Ход исследования. В каждую пробу добавляют один из следующих коагулянтов: сульфат алюминия, сульфат железа, сульфат меди в дозе 0,5 - 0,6 г/л и тщательно размешивают. Полное осветление стоков наступает через 40 - 50 минут. После слива надосадочной жидкости, осадок помещают (равномерно распределяя) в пробирки объемом 250 мл и центрифугируют в течение 3 минут при 1000 об/мин. Воду сливают, а к осадку добавляют 2 - 4 мл 1 - 3% раствора соляной кислоты для растворения хлопьев коагулянта.
Смесь размешивают и центрифугируют, жидкость сливают, а осадок оббрабатывают по методике Романенко для исследования почвы. Для облегчения доставки проб сточных вод и сокращения времени на ее первичную обработку внесение коагулянта модно производить или после доставки сточной воды в лаборатория, или до отбора проб воды. Коагуляция начинается сразу же после заполнения посуды водой. В лабораторию доставляют только осадок сточных вод, который и обрабатывают.
Эффективность метода от 82 до 91%, в среднем - 86%.
6.2.2.2. Метод исследования сточной воды на цисты кишечных простейших
по Падченко К.И. (1992)
Ход исследования. Пробы сточных вод отстаивают в течение 12 - 16 часов, затем надосадочную жидкость сливают, осадок переносят в центрифужные пробирки и центрифугируют 5 минут при 1000 об/мин. Надосадочную жидкость удаляют, осадок переносят на предметное стекло, добавляют консервант и исследуют под световым микроскопом.
Жизнеспособные цисты кишечных простейших остаются в составе этих консервантов неокрашенными. Дегенерирующие цисты окрашиваются красителем в фиолетовый цвет.
Эффективность метода, в среднем - 90%.
6.3. Исследование поверхностного стока
Отбор проб. При определении роли дождевого или паводкового стоков в обсеменении поверхностных водоемов яйцами гельминтов и цистами кишечных простейших пробы их отбирают из естественных водотоков во время дождей по окраинам населенных пунктов или в местах перед их попаданием в водоемы. Пробы воды отбирают отдельными порциями (кружками или банками) по 0,5 л из движущегося потока в широкогорлую стеклянную или пластиковую посуду с крышкой. Объем пробы - 1 л.
Можно отбирать пробы поверхностного стока и другим способом. По основным водотокам устаривают так называемые "ловушки" - ямы размером 0,5 х 0,5 х 0,1 м. Во время дождя в них происходит накопление воды поверхностного стока, из которой и отбирают пробы. При этом отбирают как воду - во флаконы, так и поверхностный слой почвы (0 - 1 см) - в пластиковые пакеты (200 г на пробу).
Пробы этикетируют, регистрируют в журнале и доставляют в лабораторию, где их хранят в холодильнике не более суток.
Ход исследования. Санитарно-паразитологическое исследование проб поверхностного стока проводят по описанным выше методикам исследования почвы и сточных вод по Романенко Н.А. и Падченко И.К.
6.4. Исследование донных отложений
Отбор проб. Пробы донных отложений отбирают в поверхностных водоемах выше-, на- и ниже мест сброса в них сточных вод, их осадков, навозных стоков, а также в местах водозабора и попадания стоков с поверхности территорий населенных пунктов, индивидуальных и фермерских хозяйств.
Для отбора проб применяют различнве системы пробоотборников: дночерпатели, драги и трубки различных конструкций. Отбор проб доннвх отложений ручным или механизированым способом проводят с берега или различных плавсредств. Пробы объемом 200 г помещают в широкогорлые стеклянные или пластиковые емкости с крышками, этикетируют, регистрируют в журнале и доставляют в лабораторию, где их хранят в холодильнике.
Ход исследования. Их объединенной пробы берут 4 навески по 25 г донных отложений и помещают в центрифужные пробирки объемом 250 мл, добавляют 150 мл чистой воды и тщательно перемешивают стеклянной палочкой. Смесь центрифугируют 5 минут при 1000 об/мин, затем надосадочную жидкость сливают, а к осадку вновь доливают 150 мл чистой надосадочной жидкости.
Промытый осадок далее исследуют по описанным выше методикам для исследования почвы на яйца гельминтов по Романенко Н.А. и цисты кишечных простейших по Падченко И.К.
6.5. Исследование осадков сточных вод
Отбор проб. Пробы "сырых" (97 - 98% влажности) осадков сточных вод из первичных и вторичных отстойников, а также с иловых площадок очистных сооружений берут с помощью черпака или кружки отдельными порциями по 100 -200 мл и сливают в широко-горлые стеклянные или пластиковые сосуды объемом 1 л с притертыми или завинчивающимися крышками.
Пробы обезвоженных (до 70% влажности) осадков сточных вод берут совком или лопатой навесками по 50 г с 4 - 5 мест иловых площадок (2 - 3-х летнего выдерживания осадка), компостных буртов, объединяют в одну пробу массой 200 - 250 г. Пробы помещают в пластиковые пакеты или баночки с крышками, этикетируют, регистрируют в журнале и доставляют в лабораторию, где их хранят в холодильнике в течение 1 - 2 суток.
6.5.1. Методика исследования осадков сточных вод на яйца гельминтов
по Романенко Н.А. (1996)
Ход исследования. "Сырой" осадок сточных вод обезвоживают: 100 - 150 мл осадка помещают в центрифужные пробирки объемом 250 мл (30 - 45 мл в пробирки объемом 84 мл) и центрифугируют в течение 5 минут при 1000 об/мин. Воду сливают, а к осадку доливают такую же порцию чистой воды и размешивают стеклянной палочкой в течение 1 - 2 минут, снова центрифугируют. Промывку осадка проводят 2 - 3 раза.
Промывку обезвоженных (влажность 70% и ниже) осадков сточных вод проводят аналогичным способом при тех же технологических режимах, помещая в центрифужные пробирки объемом 250 мл по 25 г осадка и 150 мл чистой воды.
После промывки к осадку в каждую центрифужную пробирку добавляют по 3 - 5 г чистого песка, тщательно размешивают и исследуют на яйца гельминтов по вышеописанной методике Романенко Н.А. для обработки почвы.
6.5.2. Методика исследования осадков сточных вод
на цисты кишечных простейших по Падченко И.К. (1992)
Ход исследования. Пробу осадка сточных вод, 98% влажности объемом 1 л или 0,2 кг при плотной его консистенции (70% влажности), тщательно растирают пестиком в большой фарфоровой ступке, постепенно добавляя к нему (до общего объема 1,5 л) водопроводную воду. Полученную взвесь выливают в цилиндр емкостью 2,0 л и отстаивают. Через 15 минут надосадочную жидкость переливают сифоном в цилиндр емкостью 5,0 л, а осадок повторно отмывают (2 - 3 раза) чистой водой путем встряхивания в цилиндре емкостью 2,0 л. Полученную при отмывании и собранную в большом цилиндре жидкую часть отстаивают 12 - 16 часов, надосадочную жидкость удаляют сифоном, а осадок исследуют под световым или люминесцентным микроскопом по вышеописанной методике исследования сточной воды по Падченко И.К.
6.6. Методы исследования навоза и навозных стоков
по Романенко Н.А. и Черепанову А.А.
Отбор проб. Пробы навоза и навозных стоков берут из навозосборников, навозоотстойников отдельными порциями (0,1 - 0,2 л) из 5 - 10 точек. Усредненную объединенную пробу навоза и навозных стоков объемом 1 л помещают в широкогорлые стеклянные или пластиковые сосуды с притертыми пробками или завинчивающимися крышками. Обезвоженную твердую фракцию (влажность до 70%) навоза массой 200 г помещают в полиэтиленовые пакеты или баночки. Пробы этикетируют, регистрируют в журнале и доставляют в лабораторию.
При невозможности исследования проб навоза в день доставки в лабораторию, допускается их хранение в холодильнике или в другом месте при температуре от 0° до 20°С в течение 2 суток. Чтобы не допустить развития в навозе и навозных стоках гнилостных процессов в пробы добавляют 3 - 5 капель толуола.
Ход исследования. В фарфоровую ступку помещают 100 г твердой фракции навоза, добавляют 300 мл воды и перемешивают. Полученную смесь навоза, также как и пробу навозных стоков, фильтруют через двойной слой марли, уложенный на металлический каркас. Фильтрование проводят под напором струи воды, подаваемой по резиновому шлангу из водопроводного крана. Фильтрат переносят в центрифужные пробирки и центрифугируют 3 минуты при 1500 об/мин. Надосадочный слой сливают, а к осадку добавляют насыщенный раствор нитрата натрия и снова центрифугируют. После этого в пробирки добавляют тот же флотационный раствор (до образования мениска), покрывают предметными стеклами, а через 20 минут их снимают и микроскопируют поверхностную пленку.
6.7. Методы исследования смывов с предметов обихода, рук, игрушек
Отбор проб. При определении обсемененности возбудителями паразитарных болезней предметов обихода смывы берут с посуды, скатертей или клеенок, мебели, ковров, нательного и постельного белья, халатов, спецодежды, ночных горшков, игрушек, дверей, парт, спортивного инвентаря, поручней, а также с рук детей, персонала детских учреждений, работников пищеблока, официантов, поливальщиков на оросительных системах с использованием сточных вод, их осадков, животноводческих стоков, персонала водоочистных и канализационных очистных сооружений.
Смывы берут в столовых, магазинах, детских дошкольных и школьных учреждениях, оздоровительных и спортивных лагерях, детских домах, лечебно-профилактических учреждениях, общежити-ях, библиотеках, театрах, музеях, парикмахерских, плавательных бассейнах, спортивных залах, банях, фермах, теплицах, маслозаводах, мясокомбинатах, мастерских по выделке шкур и пошиву меховых изделий.
Для отбора смывов применяют плотные ватно-капроновые тампоны, беличьи кисточки, смоченные в 1%-ном растворе едкого натра, или в 10%-ном растворе глицерина, или стирального порошка. В одну пробу, т.е. в пробирку можно собирать смывы с нескольких однородных предметов. Смывы с рук персонала берут у каждого отдельно, чтобы при обнаружении яиц гельминтов или (и) цист кишечных простейших можно было знать, какой именно сотрудник нарушает правила гигиены.
При взятии проб нужно соблюдать определенную очередность. Например, в детских учреждениях пробы вначале берут в пищеблоке, а затем в столовой, игровой комнате, спальне, умывальной и, в заключение, в санузле. Во всех детских учреждениях пробы желательно брать не менее 2 раз в год (летом и зимой). В очагах, где проводятся комплексные оздоровительные мероприятия, смывы необходимо брать значительно чаще (1 - 3 раза в квартал).
6.7.1. Метод исследования смывов на яйца гельминтов
Ход исследования. Кисточки или тампоны помещают в центри-фужные пробирки и обмывают в 1%-ном растворе едкого натра или в 10%-ном растворе глицерина, после чего жидкость центрифугируют, а осадок переносят на предметное стекло и микроскопируют.
Для снятия яиц гельминтов с рук людей рекомендуется мыть их щеткой в 2 - 3%-ном растворе питьевой соды или 1%-ном растворе едкого натра; смывные воды центрифугируют и исследуют, осадок можно также профильтровать в аппарате Гольдмана и затем исследовать фильтры. На руках особенно тщательно обмываются пальцы и подногтевые пространства.
6.7.2. Метод исследования смывов на цисты кишечных простейших
Ход исследования. Ватно-капроновые тампоны или кисточки со смывом ополаскивают в воде, затем сливают жидкость в высокий цилиндр емкостью 0,5 - 1 л с чистой водой, которую наливают с таким расчетом, чтобы при добавлении смыва не превысить общую емкость цилиндра. Всплывшие на поверхность жидкости кусочки бумаги, ткани и другие крупные частицы удаляют петлей с сеткой, а оставшуюся жидкость отстаивают в течение 12 - 16 часов, надосадочную жидкость удаляют, а к осадку добавляют консервант и исследуют по методике, описанной выше для других осадков (сточные воды).
6.8. Метод исследования снега по Чернышовой Л.Г. (1996)
Отбор проб. Пробы снега отбирают в специальные мешочки-фильтры. Они представляют собой устройство в виде мешочка-кисета круглой формы радиусом 30 - 50 см, сшитых из сатина, репса, перкаля, бязи с ячейками диаметром 0,08 - 0,04 х 0,04 - 0,012 мм. По краю мешочки подогнуты и прошиты для шнура, затягивающего их. Мешочки со снегом выдерживают при комнатной температуре в подвешенном состоянии над тазами. После таяния снега на дне мешочков остается осадок. Дно мешочков смачивают глицерином, мешочки складывают, упаковывают в полиэтиленовые пакеты, этикетируют и доставляют в лабораторию, где до их исследования хранят в холодильнике.
Ход исследования. В лаборатории осадок из мешочков смывают небольшим (0,5 л) количеством воды. Смывные воды разливают в пробирки объемом 250 мл и центрифугируют 15 минут при 1500 об/мин. Надосадочную жидкость сливают, а осадок переносят на предметные стекла и микроскопируют.
6.9. Метод исследования твердых бытовых отходов
Отбор проб. Пробы твердых бытовых отходов берут в коммунальных и индивидуальных домовладениях, детских дошкольных и школьных учреждениях, больницах (инфекционные отделения), мусоросортировочных и мусороперерабатывающих заводах.
Используют два способа отбора проб:
а) из недробленых твердых бытовых отходов отбирают крупные предметы, в т.ч. бумагу, тряпки, кости, не имеющие признаков фекального загрязнения, а из оставшейся массы отбросов для исследования отбирают 200 - 250 г;
б) из дробленных твердых бытовых отходов, предназначенных и для химического исследования, пробы берут также в количестве 200 - 250 г.
Пробы твердых бытовых отходов помещают в целлофановые пакеты, этикетируют, регистрируют в журнале и доставляют в лабораторию.
Ход исследования. Пробу недробленых твердых бытовых отходов помещают в большой кювет с 1 - 1,5 л воды. Тщательно отмывают и ополаскивают все части отходов и затем отбрасывают. Шероховатые и сильно загрязненные объекты обмывают кисточкой в той же воде и также отбрасывают. Промывные воды переливают в 2 - 3 литровую банку с широким горлом и с притертой, резиновой или корковой, покрытой целлофаном, пробкой.
Пробу дробленых твердых бытовых отходов помещают в 2 - 3-х литровую банку с 1 - 1,5 л воды и замачивают в течение 1 часа.
Банки со смывными водами или дроблеными бытовыми отходами встряхивают в шюттель-аппарате или вручную в течение 15 - 20 мин. И оставляют на 1 час для отстаивания. Затем верхний слой жидкости сливают, стараясь удалить все, что всплыло на поверхность. Остаток жидкости разливают в крупные центрифужные пробирки объемом от 60 до 250 мл (в зависимости от типа центрифуги), банку ополаскивают небольшим количеством воды, последнюю разливают по тем же пробиркам. Пробирки уравновешивают и центрифугируют в течение 3 - 5 мин при 600 об/мин; воду из пробирок сливают, а осадок обрабатывают как почву по методу Романенко Н.А. на яйца гельминтов и по методу Падченко И.К. на цисты кишечных простейших.
7. Дополнительные (рекомендуемые) методы
санитарно-паразитологических исследований
7.1. Методы исследования травы и сена на наличие личинок стронгилят
(легочных, желудочно-кишечного тракта) и адолескарий трематод
(по Котельникову Г.А., 1991)
Наибольшее количество личинок стронгилят обнаруживают в прикорневой части травы, в 3 - 5 см от почвы. Для выявления личинок нематод применяют метод Бермана. Собранную на пастбище траву (0,5 - 1 кг на пробу) перед закладкой в аппарат Бермана ножницами разрезают на части (для исследования используют нижнюю часть растений). Аппарат с травой и теплой водой оставляют на 1 - 2 часа. Затем пробирки с осадком центрифугируют 1 - 2 минуты при 800 об/мин., надосадочный слой жидкости сливают, а осадок микроскопируют на предметном стекле.
Сено, взятое из стога, исследуют аналогично.
7.1.1. Метод исследования травы по Акулину Н.А.
Метод позволяет исследовать пробы трав большой массы, что увеличивает вероятность выявления личинок стронгилят.
Оборудование: сита диаметром 31 см, высотой боковой стенки 12 см (сетка из нержавеющей проволоки, размер ячеек 1 мм), сетку укрепляют на уровне 2 см от нижнего края сита, тазы диаметром 36 см (по верхнему краю), высотой 15 см, книзу таз постепенно сужается. При внесении в таз сита нижний край последнего упирается в сужение таза. Между сеткой сита и дном таза создается пространство высотой 5 см, стеклянные воронки диаметром 18 - 20 см (по верхнему краю) с резиновыми трубками и пробирками на концах, штатив для воронок, пробирки, пипетки (глазные), раствор Люголя для фиксации личинок, предметные стекла, цилиндры, микроскоп.
Ход исследования. В тазы ставят сита и заполняют водой комнатной температуры. Уровень воды не должен доходить до верхнего края таза на 1 - 1,5 см. Образовавшиеся под сеткой пузырьки воздуха удаляют резким движением сита вверх-вниз. В каждое сито с водой вносят 100 - 120 г травы. Продолжительность выделения личинок - сутки. Для сбора личинок, осевших на дно таза, осторожно удаляют сита с травой. Через 15 - 20 минут после удаления сита надосадочную жидкость сливают, оставляя на дне таза около 1 - 1,5 л. Жидкость перемешивают и вместе с осадком переливают в воронки с пробирками на концах. Отстаивание личинок в воронках продолжается 1 - 2 часа. Остальной ход исследования проводят обычным способом. Личинки подсчитывают при малом увеличении микроскопа. В каплю воды с личинками для обезвоживания последних вносят одну каплю раствора Люголя. При обилии личинок в осадке для их подсчета применяют способ разведении.
7.1.2. Метод исследования травы на наличие
адолескарий фасциол и парамфистомат
Пробы трав собирают в биотопах моллюсков. Для отбора проб водных растений с адолескариями желательно пользоваться лупой. Адолескарий можно заметить даже невооруженным глазом на листьях и стеблях растений. Их обнаруживают преимущественно на нижней и реже верхней поверхности листьев, черешках листьев и стеблях растений. Они встречаются одиночно и группами. В лаборатории с помощью иглы и скальпеля освобождают адолескарий и изучают на предметном стекле в капле физиологического раствора.
Адолескария фасциолы внешне представляет округлое образование диаметром около 0,3 мм, прикрепившееся к растению, покрытое двумя оболочками. Если адолескария живая, то внутри цисты личинка может свободно двигаться. Это чаще наблюдается, если адолескарию поместить в каплю теплой воды (37 - 38°С). При микроскопировании видны почти одинаковые по размеру ротовая и брюшная присоски, глотка, два кишечных ствола, продолжающиеся до конца тела и экскреторный пузырь. Молодые адолескарии молочно-белого цвета, позднее они желтеют, а затем темнеют до буро-коричневого цвета. Адолескарии фасциолы гигантской по форме и размеру не отличаются от обыкновенной (рис. 1).
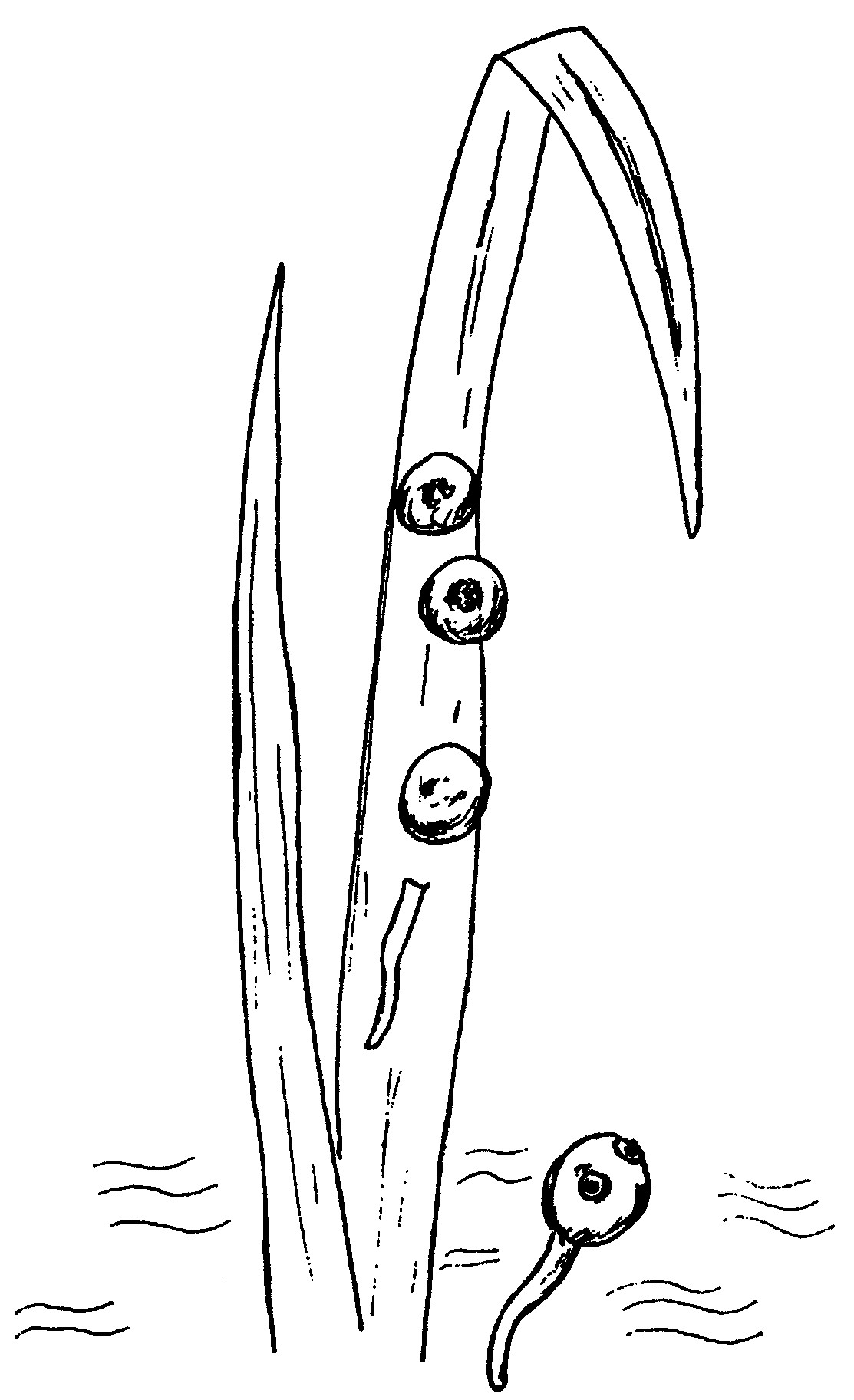
Рис. 1. Внешний вид цекария и адолескария Fasciola hepatica.
Адолескарии парамфистомат сходны с таковыми фасциол, замечаются в виде блестящих черных или коричневых точек. Тело полусферической формы, снаружи покрыто слоистой светлой оболочкой, диаметр 0,23 - 0,26 мм. Внутри цисты - подвижная личинка с теми же органами (глазки, фаринкс, брюшная присоска, экскреторные сосуды и пузырь), что и у церкария. При этом брюшная присоска очень крупная, ротовая, наоборот, рудиментарная или слабо развита.
7.1.3. Сбор церкарий и выявление адолескарий фасциолы
по методу Горохова В.В.
Для сбора адолескарий фасциолы используют стекла размером 18 х 13 см, толщиной 1,5 мм (можно куски плексиглаза размером 16 х 7 см, толщиной 1,2 мм), которые ставят вертикально, закрепляют нижнюю часть на 2 - 3 см в грунт водоема и оставляют на 7 суток. Затем их проверяют и при необходимости заменяют другими. Церкарии, встречая на своем пути стекла, прикрепляются к ним и инцистируются, превращаясь в адолескарий. Стекла просматривают невооруженным глазом. При наличии белых точек (возможно адолескарии) их исследуют под лупой. Стекла ставят в мочажины, временные водоемы, где обитают малые прудовики. Плоскости стекол должны быть обращены с востока на запад.
7.2. Исследование пыли и воздуха
по Каледину В.В. и Романенко Н.А. (1982)
Для сбора пыли используют камеру, представляющую металлический цилиндр длиной 110 - 120 мм с внутренним диаметром 27 мм (по ширине стандартного предметного стекла). В стенке цилиндра имеется всасывающее отверстие размером 2 х 25 мм. Внутри цилиндра укреплены 2 стержня, фиксирующие предметное стекло в диаметральной плоскости и продольном направлении. С одного конца цилиндр закрывают съемной крышкой, а открытым концом присоединяют к патрубку пылесоса или другого всасывающего устройства (аспиратор, воздуходувка и т.п.).
На одну сторону чистого предметного стекла наносят тонкий слой 50%-ного раствора глицерина в виде полоски 1,5 - 2 см и длиной 4 - 5 см. Стекло вставляют в камеру так, чтобы смазанная глицерином поверхность была обращена к всасывающему отверстию камеры. Камеру закрывают крышкой. Затем включают пылесос или другое всасывающее устройство и производят отбор пыли.
При отборе проб всасывающее отверстие камеры должно быть обращено к исследуемой поверхности на расстоянии 2 - 3 мм и равномерно перемещаться над ней. На одну пробу собирают пыль с площади до 0,25 м2 в течение 15 - 20 сек, воздуха - 60 сек. После отбора пробы пылесос или другое всасывающее устройство выключают, открывают камеру и извлекают предметное стекло. На смазанной стороне стекла будет отчетливо виден пылевой след, представляющий собой готовый препарат, который микроскопируют (при увеличении х 56 - 80). Если препарат получился плотным, его просветляют 1 - 2 каплями воды или 50%-ного раствора глицерина. Под микроскопом среди пылевых частиц хорошо видны яйца гельминтов. Микроскопирование препаратов может производиться на обследуемом объекте сразу после отбора проб или в лаборатории.
Сбор проб пыли и воздуха непосредственно на предметное стекло, покрытое клейкой смазкой, исключает использование фильтров, центрифугирование, приготовление мазков, во время которого могут быть потери яиц гельминтов или нарушение их целостности. Кроме того, использование клейких стекол ускоряет время отбора проб и позволяет, что особенно важно при обследовании детских учреждений, просматривать предметные стекла на местах обследования. Последнее дает возможность на местах составлять план мероприятий по предупреждению загрязнения и дегельминтизации внешней среды.
Для отбора и исследования проб пыли можно применять липкую целлофановую ленту со слоем клея до 3 мм. Ленту приклеивают к различным предметам обихода, а затем исследуют ее под микроскопом, добавив несколько капель касторового масла. Ленты шириной 20 мм и длиной 7 - 8 см следует приклеивать липким слоем к разным участкам исследуемой поверхности 6 - 8 раз в зависимости от запыленности объекта, а затем ее помещают на предметное стекло. Препарат может храниться несколько дней. В лаборатории ленту отклеивают на большом протяжении и вносят под нее несколько капель касторового или вазелинового масла (для устранения пузырьков воздуха) и исследуют при малом увеличении микроскопа. Липкой лентой нельзя делать отбор проб пыли с бумажных поверхностей (книги), волосяных игрушек и очень загрязненных предметов (половики, коврики).
7.3. Методы испытания и отбора овицидов
Основными условиями методической работы должны быть: последовательность проведения опытов и их серий, выбор оптимальной концентрации химических веществ и экспозиции, оптимальная среда для испытуемого средства, правильное определение жизнеспособности яиц.
Лабораторные опыты проводят в двух сериях. В первой - определяют степень воздействия изучаемых химических веществ на яйца гельминтов на стадии дробления и стадии инвазионной личинки.
Устанавливают концентрацию препаратов, экспозицию и стадию развития яиц.
Взвесь яиц гельминтов помещают в чашки Петри (по 600 - 800 в каждой) или бюксы. Начинают испытание препарата при 3%-ном разведении и экспозиции 30 мин. После этого яйца гельминтов отмывают водой вручную не менее 5, а с помощью центрифуги - не менее 2 раз. В контроле яйца гельминтов находятся в воде. Затем взвесь яиц гельминтов центрифугируют и выдерживают в термостате, меняя воду через каждые 2 - 3 суток. Жизнеспособность яиц (не менее 300) определяют через 15 - 20 суток общепринятыми методами. При выявлении эффективных овицидов исследования с ними повторяют, но уже в меньших концентрациях и, соответственно, экспозициях.
Во второй серии, испытывают выявленные эффективные препараты на яйца гельминтов в фекалиях. Испытывают только те препараты, которые проявили сильное или выраженное овицидное действие в первой серии. На дощечку (дерево, цемент) размером 10 х 15 см наносят 0,5 г фекалий, обсемененных яйцами гельминтов (5 яиц на 1 см3). Рабочие растворы или эмульсии испытуемых веществ наносят на дощечки с помощью пульверизатора из расчета 1 л/м2. Контрольные дощечки поливают водой. Исследования наиболее часто проводят при экспозиции от 30 до 180 мин. Затем фекалии собирают, промывают водой, выделяют яйца гельминтов и культивируют их в термостате. После определения их жизнеспособности устанавливают эффективность испытуемого средства.
Перед тем, как перейти к дальнейшей апробации выявленных овицидов определяют их токсичность и коррозионную активность.
Испытуемые соединения оценивают по степени их овицидного действия по следующей схеме. В 1 серии опытов проводят отбор химических веществ, обладающих сильными, выраженными и слабыми овицидными свойствами, т.е. с высокой, средней и слабой эффективностью. К первым относятся соединения, которые в наиболее приемлемых концентрациях вызывают гибель всех яиц гельминтов; ко вторым - соединения, убивающие свыше 50% яиц; к третьим - соединения, вызывающие гибель менее 50% яиц гельминтов. Критерий экспозиции предусматривается в пределах 30 минут. Во 2 серии опытов экспозиция увеличивается до 60 минут.
В производственных условиях оценку препаратов проводят по результатам дезинвазии помещений. Дезинвазию оценивают высокоэффективной в том случае, если овицидныи эффект (ОЭ) достигает 90 - 100%, удовлетворительной, если ОЭ равен 60 - 90%, неудовлетворительной, если ОЭ менее 60%. В данной оценке за основные критерии принимают допустимые концентрации препарата и экспозицию в пределах 3 часов.
Лабораторные опыты проводят в нескольких сериях. В первой серии используют деревянные ящики шириной 20 см, длиной 45 - 60 см, глубиной 20 - 30 см. Дно и стенки ящиков имеют отверстия, а внутри они разделены на секции, предназначенные для разных экспозиций испытуемых препаратов. В контроле используют отдельный ящик. Почву (разных видов) помещают в ящики послойно (15, 10, 5, 1 см), закладывают пробы яиц на стадии дробления и отдельно на стадии инвазионной личинки (в каждой пробе не менее 1000 яиц). Взвесь яиц гельминтов вносят на полоски фильтровальной бумаги и вокруг нее в почву, огражденную проволочным каркасом. Через 1 - 3 суток на опытные участки вносят рабочий раствор препарата, а на контрольные - воду. Первоначально испытывают 3%-ный раствор препарата при норме расхода 4 л/м2 и экспозиции 1, 3, 5 суток. Затем эти пробы извлекают, отмывают от препарата (не менее 5 раз). Выделенные из проб яйца гельминтов культивируют в термостате (24 - 26°С). Жизнеспособность их определяют через 15 - 20 суток общепринятыми методами. По результатам этих исследований оценивают овицидную эффективность препарата. Опыт повторяют, используя раствор другой концентрации и экспозиции.
Следующую серию опытов осуществляют с активными овицидами по такой же методике, но в почву при этом закладывают пробы фекалий, обсемененные, яйцами гельминтов (извлеченные из концевых отделов маток гельминтов или полученные из фекалий зараженных животных). У наиболее перспективных овицидов определяют токсические и коррозионные свойства.
Полевые и полупроизводственные опыты проводят в условиях, исключающих доступ животных и людей. Составляют схему опытов. В первой серии исследования проводят на рыхлой почве, во второй - на твердой. В третьей - на рыхлой и твердой, но после внесения препарата поверхность объекта покрывают пленкой. Во всех сериях опытов участок делят на секции в зависимости от экспозиции. Последующую работу проводят так же, как в лабораторных условиях.
Производственные опыты осуществляют в микроочагах гельминтозов.
Составляют план-схему, в которой предусматривают место и количество обрабатываемой площади, концентрацию и норму расхода рабочего раствора препарата, экспозицию, количество проб почвы, которое необходимо взять до и после обработки объекта. Пробы берут с поверхности и глубины 5, 10 и 15 см (по 4 пробы в каждом случае). Каждую пробу берут на площади не менее 20 х 30 см (масса примерно 80 - 100 г). Эти пробы служат контролем.
Для получения более объективных данных об эффективности препарата на опытных и контрольных участках необходимо производить искусственную закладку проб с яйцами гельминтов. По данным жизнеспособности яиц определяют овицидную эффективность препарата и оценивают качество проведенной дезинвазии.
Определение овицидной эффективности различных средств
В основу метода положен принцип определения экстенсэффективности антигельминтиков и соотношение живых яиц в опыте и контроле. Приводим формулу расчета по Симонову А.П.:
,
где:
ОЭ - овицидная эффективность препарата (%);
a1 - количество живых яиц гельминтов в опыте;
а2 - в контроле;
с1 - количество яиц, взятых для определения их жизнеспособности, в опыте;
с2 - в контроле;
Р1 - процент погибших яиц в опыте;
Р2 - процент живых яиц в опыте;
n - количество яиц, взятых для определения их жизнеспособности в опыте.
Этот метод может быть использован для определения ларвоцидной эффективности испытуемых средств.
Оценку степени эффективности овицидных средств в почве проводят так же, как и препаратов, испытываемых на твердых поверхностях. Различия обусловлены особенностями объекта обеззараживания и свойствами испытуемого средства. Препарат оценивается по его способности вызывать гибель зародышей гельминтов в различных слоях почвы. С этим же связано и увеличение экспозиции.
7.4. Изучение протистоцидной активности различных соединений
Необходимые для исследования концентрации водных растворов испытуемых веществ готовят по методу серийных разведений в серологических пробирках. К 1 мл каждого разведения добавляют по 0,1 мл обогащенной взвеси цист соответствующего вида кишечных простейших. О минимальной протистоцидной дозе испытуемого вещества судят по концентрации водного раствора, вызывающей гибель 100% цист в течение 1 - 2 часов.
Наблюдение за сроками выживаемости цист кишечных простейших в водных растворах испытуемых веществ осуществляют в течение 30 суток. В первые сутки осадок микроскопируют ежечасно, а затем 1 раз в сутки. Жизнеспособность цист простейших после приготовления из них препаратов определяют через различные промежутки времени при помощи люминесцентной микроскопии. В качестве люминофора применяют водный раствор акридинового оранжевого в разведении 1:500 - 1:1000. В препаратах, подвергшихся воздействию химических веществ, окрашенных водным раствором акридинового оранжевого, у жизнеспособных цист кишечных простейших оболочка слегка окрашивается в оранжевый цвет, цитоплазма остается неокрашенной и имеет темноватый оттенок. У погибших цист цитоплазма и оболочка имеют красный цвет. У дегенерирующих цист цитоплазма темно-салатного цвета, ядра ярко-салатные, четко выделяющиеся на фоне цитоплазмы.
Результаты изучения протистоцидной активности химических и других соединений используют при определении эпидемической значимости того или иного фактора передачи и разработке способов обезвреживания от цист патогенных кишечных простейших различных объектов окружающей среды, что является одним из эффективных мероприятий по профилактике вызываемых ими инвазий.
7.5. Методы экспериментального изучения сроков развития
и выживаемости яиц гельминтов в окружающей среде
При изучении сроков развития и выживаемости яиц гельминтов требуется проведение специальных экспериментов с искусственной закладкой проб на различных объектах окружающей среды. Опыты необходимо проводить, с одной стороны, в условиях наиболее приближающихся к естественным, а с другой, при которых пробы с яйцами гельминтов сохранялись бы в окружающей среде и их легко было бы извлекать для исследования в любые сроки.
Почва. На поверхности почвы закладку яиц гельминтов проводят одним из следующих способов:
а) на предварительный фильтр наносят не менее 1000 яиц гельминтов и покрывают его другим таким же фильтром, края которых загибают конвертами, после чего их укладывают на полосы плотного мельничного газа и прошивают. Расстояние между соседними фильтрами должно быть не менее 10 см, чтобы при извлечении конца ленты и забора для исследования 1 - 2 фильтров не нарушать другие; мельничный газ с пробами укладывают на поверхность опытного участка, а затем отбирают пробы для исследования;
б) на поверхности участка в почву на глубину 2 - 3 см вдавливают кювет из металлической сетки так, чтобы края его были на 2 - 3 мм выше ее поверхности. Кювет засыпают исследуемой почвой и обсеменяют яйцами гельминтов (из расчета не менее 1000 на 1 см2). И в том, и в другом случае пробы для исследования отбирают: весной и осенью 1 раз в 10 суток, летом через каждые 3 - 5 суток, зимой 1 раз в месяц.
При изучении сроков выживаемости яиц гельминтов в почве на разных глубинах (5, 10, 20, 40, 60 см) закладку их целесообразно проводить в специальных пробах.
В опытах применяют яйца тех видов гельминтов, которые представляют наибольшую эпидемиологическую опасность в данной местности. Если нужно установить максимальные сроки выживаемости яиц гельминтов, целесообразно ставить опыты с яйцами аскарид. При этом могут быть использованы как яйца A.lumbricoides, так и A.suum, полученные из рогов матки аскариды, прилегающих к вагине не далее 1 - 1,5 см, а также из фекалий с высокой интенсивностью инвазии (не менее 2 - 3 яиц гельминтов в поле зрения).
Получение чистой взвеси яиц аскарид: порцию фекалий (объемом в столовую ложку) помещают в центрифужную пробирку объемом 150 - 250 мл (лучше в пробирку объемом 250 мл) и заливают водопроводной водой (30 - 120 мл), после чего смесь тщательно размешивают палочкой до образования гомогенной массы и центрифугируют в течение 2 - 3 минут при скорости 800 об/мин. После центрифугирования надосадочную жидкость сливают, а к осадку добавляют такую же порцию чистой воды; смесь снова размешивают и центрифугируют.
Промывание повторяют не менее 2 - 3 раз. Затем к осадку добавляют насыщенный раствор натрия хлорида (плотность 1,2), смесь размешивают, всплывшие крупные частицы снимают, а смесь центрифугируют 2 - 3 минуты и петлей с поверхности раствора снимают пленку. Эти операции повторяют до тех пор, пока в контрольной капле, взятой на предметное стекло, будут попадаться лишь единичные яйца гельминтов. Затем начинают второй этап - выделение яиц гельминтов из слабого раствора соли.
Содержимое сосудов отстаивают в течение 2 - 3 часов, после чего надосадочную жидкость сливают, а осадок фильтруют через 4 - 5 слоев марли или мелкоячеистую сетку на часовые стекла диаметром 10 - 15 см. Легкими круговыми движениями производят закручивание осадка к центру часового стекла, а оставшуюся по периферии жидкость отсасывают пастеровской пипеткой с резиновой грушей. На часовые стекла добавляют небольшое количество воды, смесь снова размешивают и закручивают к центру стекла: такую операцию повторяют до тех пор, пока на стекле не будет чистая взвесь яиц гельминтов. Наблюдение за чистотой взвеси яиц гельминтов проводят под микроскопом. Полученную чистую взвесь переносят в стеклянные бюксы с крышкой, этикетируют и помещают на хранение в холодильник.
Приготовление тест-объектов. Для приготовления тест-объектов используют алюминиевые или пластмассовые бигуди, применяемые для завивки волос. Такой каркас удобен тем, что со всех сторон доступен для почвенного воздуха, влаги, почвы; кроме того, он может долго пролежать в земле, а при выкапывании предохраняет пробу почвы от разрушения. Каркас взвешивают, заполняют исследуемой почвой и снова взвешивают, по разности полученных показателей определяют массу почвы.
Через отверстия в бигуди в почве делают несколько углублений (в разных местах), в которые вносят с помощью пипеток необходимое количество капель раствора с взвесью яиц гельминтов так, чтобы на 1 г почвы их приходилось не менее 1000. Среднее количество яиц гельминтов в одной капле определяют следующим образом: на предметное стекло наносят 5 - 10 капель хорошо перемешанной взвеси. Под микроскопом подсчитывают их количество в каждой капле, суммируют и делят на число капель.
Необходимое для внесения в тест-объект количество капель взвеси определяют по формуле:
;
где:
n - число капель суспензии из яиц гельминтов;
Р0 - масса упаковки-контейнера без почвы;
Р1 - масса упаковки с почвой;
k - среднее число яиц гельминтов в 1 капле;
1000 - содержание яиц гельминтов в 1 г почвы после обсеменения.
После внесения взвеси яиц гельминтов углубления в каркасе заполняют почвой. Тест-объект заворачивают в мельничный газ, после чего к нему прикрепляют проволоку длиной на 5 - 10 см больше глубины закладки их в почву. После помещения тест-объектов в почву на концах проволоки, выведенных наружу, устанавливают опознавательные знаки. Лучше всего пробы (тест-объекты) готовить в лаборатории и хранить до постановки опыта в холодильнике.
Для закладки тест-объектов на выбранных участках выкапывают ямы шириной 1 - 1,2 м. Длину их рассчитывают в каждом конкретном случае отдельно (в зависимости от количества испытуемых проб). На дно ям укладывают пробы (тест-объекты) на расстоянии 20 - 30 см друг от друга; ямы засыпают сначала той почвой, которая выбрасывалась последней при копке ям; на поверхности полученных грядок устанавливают опознавательные знаки.
Количество тест-объектов должно быть рассчитано на длительный период наблюдения (7 - 10 лет), выемку их для исследования производят в зависимости от климата, характера почв и глубины закладки - не реже 1 раза в месяц при исследовании тест-объектов с глубины до 20 см и не реже 1 раза в квартал при более глубоких закладках. Учитывая, что тест-объекты для исследования можно забирать (для средней полосы России) только с апреля по октябрь, т.е., в течение 7 месяцев, легко подсчитать число тест-объектов, необходимых для закладки на ту или иную глубину (на глубину 5, 10, 20 см в среднем 49 - 70 штук; на глубину 40 и 60 см - 21 - 30 штук).
По опознавательным знакам определяют места нахождения тест-объектов, выкапывают ямы размером 30 х 30 см так, чтобы между стенкой ямы и ближайшим тест-объектом был оставлен слой почвы не менее 10 см. Изъятые из почвы тест-объекты помещают в пакеты из бумаги или целлофана и доставляют в лабораторию для исследования. При определении стадии развития или признаков деформации в каждом опыте необходимо просматривать не менее 100 - 200 яиц гельминтов.
Для изучения сроков развития и выживаемости личинок анки-лостомид и стронгилоидов в почве рекомендуется следующая методика: фекалии, содержащие яйца анкилостомид, смешивают с почвой в пластмассовых кюветах (на дне которых просверлены отверстия; последние помещают в почву экспериментальных участков на 7 - 10 дней и ведут ежедневно отбор проб обсемененной почвы для исследования по методу Бермана. Поиск проводят до тех пор, пока вылупившиеся из яиц личинки не достигнут инвазионной стадии, а затем погибнут.
Вода. Для изучения сроков выживаемости яиц гельминтов в воде несколько капель насыщенной взвеси их (не менее 1000) наносят пипеткой на предварительные планктонные фильтры, сложенные воронками. Для устойчивости воронки помещают в штатив из небольшой картонной крышки, в которой сделаны ячейки. После внесения яиц края воронок загибают и вместе с этикетками, указывающими даты и номера опытов, помещают по 2 - 3 экземпляра в стеклянные трубки. Наиболее удобными являются трубки длиной около 7 см, диаметром 2 см с небольшими раструбами, за которые с обеих сторон закрепляют сатин при завязывании отверстий трубок.
В металлическую сетку заворачивают по 3 - 4 трубки и на капроновом шнуре опускают в воду. Если пробы намечено поставить в местах с быстрым течением воды, для удержания проб на необходимой глубине к сетке подвешивают дополнительный груз. Серия из 3 - 4 трубок, связанных вместе, составляет 1 опыт. Часть трубок подвешивают у дна, остальные на различном расстоянии от него. Для просмотра берут по 1 трубке из каждого опыта. Подсчитывают не менее 200 яиц, смытых с фильтра на предметное стекло.
Овощи. Яйца гельминтов (не менее 1000) наносят непосредственно на овощи. Сроки их нахождения на овощах определяют временем роста последних. Опытные овощи помечают, а через нужное время забирают на исследование. Яйца гельминтов очищают скальпелем с поверхности овощей на фильтр и помещают во влажную камеру для развития их в оптимальных лабораторных условиях.
Наблюдения показали, что яйца гельминтов на овощах, не защищенных листьями, смываются дождем. Поэтому взвесь яиц гельминтов целесообразно помещать на фильтрах, которые с помощью ниток крепко фиксируют на поверхности овощей. Для исследования берут не менее 3 фильтров, в каждом из них просматривают не менее 200 - 300 яиц гельминтов, определяя их стадию развития или признаки деформации.
7.6. Методы экспериментального изучения сроков
выживаемости цист кишечных простейших
в различных условиях окружающей среды
Почва. Для проведения экспериментальных исследований по изучению сроков выживаемости цист патогенных кишечных простейших следует использовать цисты лямблий. Они, при наличии одинаковых микроклиматических условий в окружающей среде, не отличаются по своей устойчивости от таковой цист дизентерийных амеб. Цисты лямблий выделяют из фекалий больных людей методом механического обогащения.
Для проведения опытов из взвеси цист лямблий готовят специальные тест-объекты: на мембранные фильтры № 4 или № 6 наносят 0,2 мл взвеси, содержащей не менее 4 - 5 тысяч жизнеспособных цист. Фильтры складывают по типу конверта и помещают в капроновые мешочки размером 3 х 2,5 см, которые вкладывают в среднюю, нижнюю и верхнюю части перфорированных алюминиевых трубок длиной 10 см, диаметром 2 х 2,5 см, содержащих почву с подопытных участков. Трубки с пробами цист кишечных простейших размещают на расстоянии 8 - 10 см друг от друга в алюминиевой сетке сечением 30 х 50 см и высотой 7 - 10 см, которая предварительно заполняется почвой с подопытного участка. Сетку закапывают в почву на такую глубину, чтобы верхний конец алюминиевых трубок находился на уровне поверхности почвы. Сетку засыпают сверху тонким слоем почвы подопытного участка.
Трубки с пробами цист кишечных простейших вынимают из почвы и доставляют в лабораторию для исследования 1 раз в неделю. Извлеченные из трубок капроновые мешочки ополаскивают чистой водой. Жизнеспособные и погибшие цисты кишечных простейших, содержащиеся на мембранных фильтрах, могут быть идентифицированы под люминесцентным микроскопом при помощи акридинового оранжевого. На предметное стекло наносят каплю 0,1 - 0,2%-ного водного раствора акридинового оранжевого и делают отпечаток с развернутого фильтра, извлеченного из капронового мешочка. Тщательно смывают красителем с фильтра взвесь цист. Полученную на предметном стекле смесь накрывают покровным стеклом и спустя 30 - 45 минут исследуют под люминесцентным микроскопом.
У живых цист наблюдается лишь слегка окрашенная в оранжевый цвет оболочка, а цитоплазма имеет темноватый оттенок. Цитоплазма и оболочка у погибших цист окрашивается в красный или красно-кирпичный цвет.
При отсутствии в лаборатории люминесцентного микроскопа идентификацию жизнеспособных и нежизнеспособных цист кишечных простейших осуществляют под световым микроскопом в препаратах, окрашенных акридиновым оранжевым. Препараты готовят в этом случае по той же методике, что и при люминесцентной микроскопии. Под световым микроскопом жизнеспособные цисты кишечных простейших остаются неокрашенными, а мертвые приобретают желтую окраску.
Для определения соотношения между жизнеспособными и нежизнеспособными цистами достаточно подсчитать их число в 3 - 5 рядах покровного стекла. Число жизнеспособных и погибших цист, содержащихся в исследуемой пробе, определяют по формуле:
Х = А · В · С · Д ,
где:
Х - число живых или погибших цист соответствующего вида кишечных простейших, содержащихся в пробе;
А - число цист, обнаруженных в 1 ряду под покровным стеклом;
В - число рядов покровного стекла, которое было использовано для подсчета цист;
С - число капель в 1 мл смыва;
Д - объем смыва с мембранного фильтра (мл).
О динамике отмирания цист судят по изменению количественного соотношения между жизнеспособными и погибшими цистами.
Сточные воды. Первый этап приготовления тест-объектов в мембранных фильтрах, вложенных в капроновые мешочки, остается таким же, как и при определении сроков выживаемости цист кишечных простейших в почве. Затем мешочки перевязывают сверху нитками и погружают в пробирки высотой 10 - 15 см, диаметром 2 см. В пробирки наливают изотонический раствор натрия хлорида для предупреждения гибели цист до момента погружения пробирок в сточную воду. Для того, чтобы предупредить всплывание в пробирке мешочков с пакетиками исследуемого материала, в них вкладывают кусочки гранита величиной с фасоль. Пробирки с исследуемым материалом помещают в перфорированные жестяные банки, к которым прикрепляется тонкая медная проволока. Перед погружением банок в исследуемую сточную воду изотонический раствор натрия хлорида из пробирок удаляют. Банки с пробками фиксируют при помощи проволоки в условиях опытной канализационной установки. Пробы для исследования извлекают 1 раз в неделю и обрабатывают по той же методике, что и почву.
Поверхность твердых материалов. Обогащенную взвесь цист кишечных простейших объемом 0,2 мл наносят тонким слоем на поверхность опытных образцов, которые помещают в емкости, позволяющие активно регулировать температуру и относительную влажность воздуха. В качестве таких емкостей можно использовать термостат и холодильник, необходимая температура в которых устанавливается при помощи терморегуляторов. Обеспечение необходимой влажности воздуха достигается путем помещения в указанные емкости соответствующего количества чашек Петри с дистиллированной водой, в которой увлажняются полоски из марли. Выживаемость цист целесообразно изучать при температуре 2 - 6°С и 18 - 27°С, относительной влажности воздуха 40 - 65% и 80 - 100%. Определение температуры и относительной влажности воздуха производят при помощи термовлагобарометра БМ-2.
Жизнеспособность цист определяют при помощи методов витального окрашивания и люминесцентной микроскопии.
Для того, чтобы установить предельные сроки выживаемости и интенсивность гибели цист кишечных простейших на поверхности опытных образцов, изготовленных из стекла, на изучаемую взвесь цист наносят через определенные промежутки времени каплю 0,1%-ного водного раствора эозина или 1 каплю 0,1 - 0,2%-ного водного раствора акридинового оранжевого, тщательно растирают в ней исследуемую взвесь, покрывают покровным стеклом и просматривают приготовленные препараты соответственно при помощи светового или люминесцентного микроскопа. При изучении выживаемости цист кишечных простейших на опытных образцах, изготовленных из светонепроницаемых материалов (металлы, дерево, полимеры, картон и др.) исследуемую взвесь цист вначале тщательно смешивают на поверхности опытного образца с водным раствором соответствующего красителя, затем каплю этой взвеси переносят на предметное стекло, покрывают ее покровным стеклом, и анализируют под световым или люминесцентным микроскопом. В препаратах, окрашенных раствором эозина, жизнеспособные цисты кишечных простейших остаются неокрашенными, а мертвые приобретают розовую окраску. Характер окраски живых и погибших цист при применении акридинового оранжевого под световым и люминесцентным микроскопом такой же, как и при определении их жизнеспособности в почве.
7.7. Методы определения жизнеспособности
яиц и личинок гельминтов
Жизнеспособность яиц гельминтов определяют по внешнему виду, путем окрашивания витальными красками, культивированием в оптимальных условиях и постановкой биологической пробы.
7.7.1. Определение жизнеспособности яиц или личинок
гельминтов по внешнему виду
Яйца гельминтов микроскопируют вначале при малом, затем при большом увеличении. У деформированных и мертвых яиц гельминтов оболочка разорвана или прогнута внутрь, плазма мутная, разрыхлена. У сегментированных яиц шары дробления (бластомеры) неравного размера, неправильной формы, часто сдвинуты к одному полюсу. Иногда встречаются аномальные яйца, которые, имея внешние уродства, развиваются нормально. У живых личинок аскарид мелкая зернистость имеется только в средней части тела, по мере их гибели она распространяется по всему телу, появляются крупные блестящие гиалиновые вакуоли, так называемые, "нитки жемчуга".
Для определения жизнеспособности зрелых яиц аскарид, власоглавов, остриц следует вызывать активные движения личинок легким подогреванием препарата (до температуры не выше 37°С). Жизнеспособность личинок аскарид и власоглавов удобнее наблюдать после их выделения из скорлупы яйца надавливанием на покровное стекло препарата препаровальной иглой или пинцетом.
У инвазионных личинок аскарид часто замечается чехлик, отслоившийся на головном конце, а у закончивших развитие в яйце личинок власоглавов на этом месте при большом увеличении обнаруживается стилет. У погибших личинок гельминтов независимо от их места нахождения (в яйце или вне его) замечают распад тела. При этом внутренняя структура личинки становится глыбчатой или зернистой, а тело мутным и непрозрачным. В теле обнаруживаются вакуоли, а на кутикуле - разрывы.
Жизнеспособность онкосфер тениид (бычьего, свиного цепней и др.) определяют по движению зародышей при воздействии на них пищеварительных ферментов. Яйца помещают на часовое стекло с желудочным соком собаки или искусственным дуоденальным соком. Состав последнего: панкреатина - 0,5 г, натрия бикарбоната - 0,09 г, дистиллированной воды - 5 мл. Часовые стекла с яйцами ставят в термостат при 36 - 38°С на 4 часа. При этом живые зародыши освобождаются от оболочек. Оболочки живых онкосфер также растворяются в подкисленном пепсине и в щелочном растворе трипсина через 6 - 8 часов в термостате при 38°С.
Если поместить яйца тениид в 1%-ный раствор натрия сульфида или 20%-ный раствор натрия гипохлорида, или же в 1%-ный раствор хлорной воды при 36 - 38°С, зрелые и живые зародыши освобождаются от оболочек и не изменяются в течение 1 суток. Незрелые и мертвые онкосферы сморщиваются или набухают и резко увеличиваются, а затем "растворяются" в течение 10 минут - 2 часов. Живые зародыши тениид также активно двигаются в смеси 1%-ного раствора натрия хлорида, 0,5%-ного раствора натрия гидрокарбоната и желчи при 36 - 38°С.
Жизнеспособность адолескариев фасциол, собранных на растениях и других объектах водоемов, проверяют исследованием их на предметном стекле в физиологическом растворе под микроскопом с нагревательным столиком. При подогревании личинки трематоды, находящиеся в цисте, начинают двигаться.
Для определения жизнеспособности яиц карликового цепня наиболее проста методика Иониной Н.С.: у живых яиц медианная пара эмбриональных крючьев или параллельна латеральным, или последние образуют с медианной угол у основания меньше 45°. У мертвых яиц латеральные пары образуют у основания угол с медианной парой больше 45° или же крючья беспорядочно разбросаны (утрачивается их парное расположение); иногда наблюдается смор-щивание зародыша, образование зернистости. Более точен метод, основанный на появлении движений онкосферы при резкой смене температур: от 5 - 10° до 38 - 40°С.
Определение жизнеспособности незрелых яиц нематод следует изучать во влажной камере (чашках Петри), помещая яйца аскарид в 3%-ный раствор формалина, приготовленный на изотоническом растворе натрия хлорида при температуре 24 - 30°С, яйца власоглавов в 3%-ном растворе соляной кислоты при температуре 30 - 35°С; яйца остриц в изотоническом растворе натрия хлорида при температуре 37°С. Чашки Петри следует открывать 1 - 2 раза в неделю для лучшей аэрации и снова увлажнять фильтровальную бумагу чистой водой.
Наблюдения за развитием яиц гельминтов ведут не реже 2 раз в неделю. Отсутствие признаков развития в течение 2 - 3 месяцев свидетельствует о их нежизнеспособности. Признаками развития яиц гельминтов являются сначала стадии дробления, деление содержимого яйца на отдельные бластомеры. В течение первых дней развивается до 16 бластомер, которые переходят во вторую стадию - морулу и т.д.
Яйца анкилостомид культивируют в стеклянном цилиндре (высотой 50 см и диаметром 7 см), закрытом пробкой. Смесь из равных объемов стерильного песка, древесного угля и испражнений с яйца ми анкилостомид, разведенную водой до полужидкой консистенции, наливают осторожно на дно цилиндра при помощи стеклянной трубки. В течение 1 - 2-суточного отстаивания в темноте при температуре 25 - 30°С из яиц вылупляются рабдитовидные личинки, а через 5 - 7 суток они становятся уже филяриевидными: личинки выползают вверх по стенкам цилиндра, где видны даже невооруженным глазом.
Яйца трематод, естественно развивающиеся в воде, например, описторхисов, дифиллоботриид, фасциол и других, помещают на часовое стекло, чашку Петри или в другой сосуд, наливают небольшой слой обычной воды. При культивировании яиц фасциол следует учесть, что они развиваются быстрее в темноте, при этом в живых яйцах при температуре 22 - 24°С через 9 - 12 суток формируется мирацидий. При микроскопировании развивающихся яиц трематод хорошо заметны движения мирацидия. Мирацидий фасциолы из оболочек яйца выходит только на свету.
Метод Фюллеборна. Личинки анкилостомид и стронгилид культивируют на агаре в чашке Петри с животным углем. После выдерживания в термостате при температуре 25 - 30°С в течение 5 - 6 часов личинки расползаются по агару, оставляя за собой дорожку из бактерий.
Метод Харада и Мори. В пробирки, помещенные в штатив, добавляют 7 мл дистиллированной воды. Деревянной палочкой берут 0,5 г испражнений и делают мазок на фильтровальной бумаге (15 х 150 мм) в 5 см от левого края (эту операцию проводят на листе бумаги, чтобы защитить поверхность лабораторного стола). Затем полоску с мазком вставляют в пробирку так, чтобы свободный от мазка левый конец достигал дна пробирки. Накрывают верхний конец куском целлофана и плотно обхватывают резинкой. На пробирке пишут номер, фамилию обследуемого. В таком состоянии пробирки хранят 8 - 10 суток при температуре 28°С. Для изучения личинок снимают и удаляют целлофановую крышку и извлекают пинцетом полоску фильтровальной бумаги. При этом следует проявлять осторожность, так как небольшое количество инвазионных личинок может передвигаться к верхнему концу фильтровальной бумаги или к стенке пробирки и проникать под поверхность целлофана.
Пробирки помещают в горячую водяную баню при температуре 50°С на 15 минут, после чего содержимое их встряхивают и быстро переливают в 15-миллилитровую пробирку для осаждения личинок. После центрифугирования надосадочную жидкость удаляют, а осадок переносят на предметное стекло, накрывают покровным стеклом и микроскопируют под малым увеличением.
Для дифференциального диагноза филяриевидных личинок необходимо пользоваться данными таблицы 3.
Таблица 3
Дифференциальная диагностика филяриевидных личинок
A.duodenale, N.americanus, S.stercoralis, Trichostrongylus sp.
Личинки | Размеры | Характерные признаки |
A.duodenale | Длина тела около 660 мкм, чехлика - 720 нм | Исчерченность чехлика менее выражена, ротовой выступ менее заметен, передний конец тела (но не чехлика) тупой, диаметр кишечной трубки меньше, чем бульбус пищевода, хвостовой конец тупой |
N.americanus | Длина тела около 590 мкм, чехлика - 660 нм | Чехлик заметно исчерчен, особенно в хвостовой части тела, ротовой выступ кажется темным, передний конец тела (но не чехлика) закруглен подобно узкому концу куриного яйца, передняя часть кишечной трубки такого диаметра, как бульбус пищевода, хвостовой конец резко заострен |
S.stercoralis | Длина тела около 500 мкм | Личинка без чехлика, пищевод составляет около половины длины тела, хвост тупой или разветвленный |
Trichostrongylus sp. | Длина тела около 750 мкм | Просвет кишечника не прямой, а зигзагообразный, хвостовой конец закруглен и имеет форму кнопки |
7.7.2. Методы окрашивания яиц и личинок гельминтов
Мертвые ткани в большинстве случаев воспринимают краски быстрее, чем живые. Эти особенности используют в гельминтологии для определения жизнеспособности яиц и личинок гельминтов. Однако в отдельных случаях некоторые краски лучше воспринимаются живыми тканями, чем мертвыми.
Для дифференциального определения живых и мертвых яиц и личинок применяют следующие краски и способы.
Для окраски живых и мертвых тканей часто используют лейко-базу метиленового синего. Живая клетка или ткань редуцирует метиленовый синий в бесцветную лейкобазу, мертвая ткань не обладает такой способностью, поэтому приобретает окраску.
Критерием состояния яйца является окрашивание зародыша, но не оболочки. Такая его способность связана с условиями гибели яйца. В тех случаях, когда волокнистая оболочка в мертвом яйце не теряет свойств полупроницаемости, она не будет пропускать красители, следовательно, мертвый зародыш не будет окрашиваться. Окрашенный зародыш всегда свидетельствует о гибели яйца.
Для окраски яиц аскарид можно использовать метиленовый синий в растворе молочной кислоты с едкой щелочью (метиленового синего 0,05 г, едкого натра 0,5 г, молочной кислоты - 15 мл). Живые яйца окраску не воспринимают; окрашиваются в синий цвет зародыши мертвых яиц. Окрашивание личинок аскарид основным раствором краски бриллианткрезилового синего в концентрации 1:10000 осуществляют следующим образом: на предметное стекло наносят каплю жидкости с яйцами аскарид и каплю основного раствора краски. Препарат накрывают покровным стеклом, которое плотно прижимают к предметному стеклу при легком постукивании препаровальной иглой. Под микроскопом наблюдают количество вышедших личинок и степень их окрашиваемости; после чего этот же препарат просматривают повторно через 2 - 3 часа. Живыми считаются только недеформированные личинки, не окрасившиеся в течение 2 часов. Мертвые личинки или не выходят из яиц или окрашиваются при разрыве скорлупы (частично или полностью).
При определении жизнеспособности яиц аскаридий птиц возможна окраска препаратов 5%-ным спиртовым раствором йода. При его нанесении на препарат зародыши мертвых яиц аскаридий в течение 1 - 3 сек. окрашиваются в оранжевый цвет.
Мертвые яйца описторхисов и онкосферы бычьего цепня окрашиваются раствором толуидинового синего (1:1000), а мертвые онкосферы бычьего цепня - раствором бриллианткрезилового синего (1:10000). При этом приобретают цвет зародыши и оболочки как мертвых, так и живых яиц. Поэтому после окраски яйца и онкосферы отмывают в чистой воде и дополнительно окрашивают их сафранином (в разведении 1:10000 спирта 10°С). Спирт удаляет краску с оболочек, а сафранин окрашивает в красный цвет. В результате живые яйца окрашиваются в красный цвет; яйца с мертвыми зародышами - в синий, а оболочка остается красной. Мертвые зародыши онкосфер бычьего цепня быстро, в течение нескольких минут, окрашиваются в ярко-красный или розовый цвет сафранином или в синий цвет бриллианткрезиловым синим в разведении 1:4000, или индигокармином в разведении 1:1000 - 1:2000. Живые зародыши не изменяются под влиянием этих красок даже спустя 2 - 7 часов.
Для определения жизнеспособности яиц карликового цепня рекомендуется использовать следующие краски:
1. Бриллианткреазиловый синий (1:8000) - через 1 час у мертвых яиц особенно ярко окрашивается онкосфера, которая резко выделяется на бледном или бесцветном фоне остальной части яйца;
2. Сафранин (1:8000 при воздействии в течение 2 часов и 1:5000 - в течение 3 - 5 часов);
3. 50%-ный раствор пирогалловой кислоты в разведении 1:2 - при воздействии в течение 1 часа при температуре 29 - 30°С (чем ниже температура, тем продолжительнее процесс окрашивания).
7.7.3. Люминесцентный метод исследования яиц и личинок гельминтов
Люминесцентная микроскопия дает возможность дифференцировать живые и мертвые объекты без повреждения яйца. Для флюоресценции используются не ультрафиолетовые лучи, а сине-фиолетовая часть видимого света, с обычным микроскопом и предметными стеклами; к осветителю ОИ-18 добавляют специальный набор цветных фильтров.
Живые и мертвые яйца аскарид, остриц, карликовых цепней, бычьего цепня, широкого лентеца и других гельминтов люминесцируют неодинаково. Это явление наблюдается как при первичной люминесценции без применения красителей, так и при окраске флюорохромами (акридиновый оранжевый, корифосфин, примулин, ауролин, сульфат берлерина, трипафлавин, риванол, акрихин и др.)
Неокрашенные, живые несегментированные яйца аскарид светятся ярко-зеленым светом с желтоватым оттенком; у мертвых яиц оболочка излучает зеленый свет значительно ярче, чем темно-зеленая зародышевая часть; у яиц аскарид с личинкой проявляется только оболочка, а у мертвых - и оболочка, и личинка ярко-желтого цвета.
Непигментированные и несегментированные живые яйца остриц и карликовых цепней излучают зеленовато-желтый свет, у мертвых яиц интенсивно люминесцирует оболочка на фоне темно-зеленой зародышевой массы.
При вторичной люминесценции (при окраске акридин-оранжевым в разведении 1:10000 и 1:50000 от 30 минут до 2 часов) оболочка живых и мертвых нематод, трематод и цестод люминесцирует неодинаково.
Скорлупа живых и мертвых яиц аскарид, токсокар, остриц, карликовых цепней, крысиных цепней, бычьего цепня, лентецов окрашиваются в оранжево-красный цвет. Зародыши живых яиц аскарид, токсаскарисов, крысиного цепня, широкого лентеца и онко-сферы бычьего цепня люминесцируют тусклым темно-зеленым или серо-зеленым цветом. Мертвые зародыши яиц этих гельминтов излучают "горящий" оранжево-красный цвет. Живые личинки остриц и токсокар (освобожденные от скорлупы яйца) излучают тусклый серо-зеленый свет, при их гибели цвет изменяется от головного конца в "горящий" светло-зеленый, затем желтый, оранжевый и, наконец, в ярко-оранжевый.
При окраске флюорохромами - корифосфилом, примулином у мертвых яиц аскарид и власоглавов наблюдается свечение от лилово-желтого до медно-красного цвета. Жизнеспособные яйца не люминесцируют, а окрашиваются в темно-зеленый цвет.
Живые яйца трематод (парагонимусов и клонорхисов) не люминесцируют после окраски акридиновым оранжевым, а от мертвых яиц исходит желтовато-зеленый цвет.
Метод люминесценции может быть применен и для определения жизнеспособности личинок гельминтов. Так, флюорохромиро-ванные раствором акридинового оранжевого (1:2000) личинки стронгилят, рабдитат светятся: живые - зеленым (с оттенком), мертвые - ярко-оранжевым светом.
Живые мирацидии, вышедшие из оболочки, излучают тусклый голубоватый свет с еле заметным светло-желтым венчиком ресничек, но спустя 10-15 минут после гибели проявляются ярким "горящим" светло-зеленым, а затем - оранжево-красным светом.
7.7.4. Метод биологической пробы
Биологическая проба - определение жизнеспособности инвазионных яиц гельминтов посредством их скармливания лабораторным животным. Это наиболее точный метод. Личинками гельминта заражают соответствующего промежуточного или окончательного хозяина, можно использовать также лабораторных животных, которым скармливают зрелые яйца или личинки паразитов.
Например, для определения жизнеспособности яиц аскаридат (аскариды свиные, человека, токсокары, токсаскарис и др.) на одно животное (морские свинки, мыши) необходимо не менее 100 - 300 яиц с развившейся личинкой. Яйца аскаридат в изотоническом растворе натрия хлорида вводят пипеткой через рот мыши или морской свинке. Через 6 - 7 суток животное забивают, вскрывают и исследуют его печень и легкие в отдельности на наличие личинок аскаридат. Для этого печень и легкие измельчают ножницами на мелкие кусочки и исследуют их по методу Бермана или Супряги (раздел 6.1.2.)
Если животных заражали живыми инвазионными яйцами, то при вскрытии в печени и легких обнаруживают мигрирующие личинки аскаридат.
Для определения жизнеспособности адолескариев фасциол, собранных на растениях в биотопах малого прудовика - промежуточного хозяина паразита, используют мышей, морских свинок или кроликов, которым скармливают эти личинки или вводят их пипеткой через рот.
В случае заражения яйца фасциол в фекалиях лабораторных животных можно обнаружить у кроликов через 2 месяца, у морских свинок - через 50 суток, у мышей - через 35 - 40 суток.
Для более быстрого получения ответа лабораторных животных вскрывают через 20 - 30 суток и исследуют печень на наличие молодых фасциол.
Для определения жизнеспособности яиц карликового цепня также рекомендуется их скармливание незараженным ими ранее белым мышам с последующим вскрытием животных через 92 - 96 часов и выявлением цистицеркоидов в кишечных ворсинках или цес-тод в просвете кишечника.
Для определения жизнеспособности яиц описторхисов рекомендуется метод (Герман С.М., Бэер С.А., 1984), основанный на физико-химической активации железы вылупления мирацидия и стимуляции двигательной активности личинки, что приводит к от-крыванию крышечки яйца и активному выходу мирацидия в экспериментальных условиях.
Взвесь яиц описторхисов в воде предварительно охлаждают до 10 - 12°С (все последующие операции осуществляют при комнатной температуре 19 - 20°С). В центрифужную пробирку вносят 1 каплю взвеси, содержащую 100-150 яиц. Пробирку ставят в штатив на 5 - 10 минут. За это время все яйца успевают опуститься на дно. Затем полоской фильтровальной бумаги осторожно отсасывают излишек воды и в пробирку добавляют 2 капли специальной среды. Среду готовят на 0,005 М Трис-HCl буфере; в буфер добавляют 12 - 13%-ный раствор этанола и краситель (фуксин, сафранин, эозин, метиленовый синий и т.д.). Пробирку встряхивают, ее содержимое переносят пипеткой на предметное стекло и оставляют на 10 минут, слегка покачивая. Затем добавляют 2 капли указанной среды. Препарат готов для микроскопирования под обычным световым микроскопом при 20-кратном увеличении.
За это время у жизнеспособных личинок открывается крышечка, и мирацидий активно выходит в указанную среду. Благодаря наличию в ней этанола, они через 2 - 5 минут обездвиживаются и затем окрашиваются с помощью красителя. Их легко можно обнаружить и посчитать при микроскопировании.
7.8. Методы исследований моллюсков на наличие церкариев шистоматид
7.8.1. Возбудители церкариозов
Церкариозы (церкариальные, или шистосоматидные дерматиты; народные названия: "зуд пловцов", "зуд купальщиков", "водяной зуд", "водяная крапива") - паразитарные заболевания, вызываемые личинками (церкариями) ряда видов трематод семейства Schistosomatidae. Во взрослом состоянии они паразитируют в кровеносной системе задних отделов кишечника водоплавающих птиц (утиных, чайковых). Человек играет роль неспецифического (абортивного) хозяина, однако церкарии шистосоматид способны проникать через его кожные покровы, вызывая механические (часто множественные) поражения кожи, оказывая токсическое и сенсибилизирующее воздействие продуктами обмена и распада, способствуя заносу вторичной инфекции.
Основным видом шистосоматид, способным вызывать церкариоз у человека в России, является трематода - Trichobilharzia ocellata (возможно и Т.szidati) , в меньшей степени: Bilharziella polonica, Dendtritobilharzia pulverulenta - паразитами утиных птиц, а также - Ornithobilharzia intermedia - паразитом чайковых.
Церкарии шистосоматид относятся к группе "вилкохвостых" (или - фуркоцеркарий), т.к. их хвост на конце - раздвоен в виде вилки (рис. 2). Похожее строение хвоста имеют и церкарии трематод некоторых других семейств, например, Diplostomatidae, Strigeidae, также паразитов водоплавающих птиц, которые, тем не менее, не нападают на человека и не вызывают дерматиты (рис. 3). Учитывать этот факт необходимо для избежания неверной экспертной оценки и ошибочного завышения степени риска заражения человека церкариями в конкретных обследуемых водоемах.
Рис. 2. Строение цекарии Trichobilharzia группы ocellata:
1 - передний (головной) орган с ротовой присоской, 2 - тело цекарии, 3 - брюшная присоска, 4 - железы проникновения, 5 - стебель хвоста, 6 - фурки хвоста.
А - вид сбоку, Б - вид сверху.
Рис. 3. Формы тела и типичные "позы" живых, вышедших из
инвазированных моллюсков, цекарий трематод:
1 - семейство Schistosomatidae;
2 - семейство Diplostomatidae;
3 - семейство Strigeidae;
4 - семейство Opisthorchidae;
5 - семейство Lecithodendriidae.
Церкарии Т.ocellata довольно крупные; их общая длина (тело церкарии + стебель хвоста + фурки) достигает 1,0 - 1,3 мм. Более детально размеры церкарии выглядят следующим образом (все цифры даны в микронах): длина тела церкарии вместе с головным органом - 215 - 360, ширина - 50 - 90, длина стебля хвоста - 300 - 375, ширина стебля хвоста - 34 - 45, длина вилок (фурок) хвоста - 200 - 275, диаметр переднего (головного) органа - 60 - 85, диаметр брюшной присоски - 35.
Тело церкарии прозрачное, слегка желтоватого цвета. Железы проникновения (пять пар) колбовидной формы, хорошо видны выводные протоки. На дорзальной поверхности головного органа имеется два пигментированных глазка, расположенных немного впереди брюшной присоски. Стебель хвоста длиннее фурок. Утолщение в передней части стебля хвоста отсутствует. Брюшная присоска церкарии мощная, хорошо заметна (особенно при боковом положении церкарии) и может выпячиваться в виде "трубки".
Церкарии выходят из инвазированных моллюсков преимущественно в дневное время суток. Не совершая дальних активных миграций в водоемах, они оседают на водных растениях, прикрепляясь брюшными присосками. Ежесуточно из инвазированных моллюсков может выходить до 10 и более тысяч церкарий. Будучи потревоженными, они начинают активно плавать и, встречаясь с открытыми кожными покровами теплокровных (птиц, человека), быстро (в течение нескольких секунд) внедряются в них.
Движения живых, вышедших из моллюсков в воду, церкарий (при наблюдении под бинокуляром МБС, при увеличении в 20 - 40 раз) энергичные, как бы "ввинчивающиеся в воду хвостом вперед". Церкарии двигаются в направлении "к свету" и почти мгновенно реагируют на изменения освещенности. Механические колебания воды и растительного субстрата, имитирующие движение лапок утки, стимулируют движения церкарий. Церкарии остаются жизнеспособными и инвазионными в течение двух суток при температуре воды 17 - 20°С и не менее трех суток при 5 - 10°С.
Церкарии держатся в поверхностном слое воды или на глубине до 30 - 40 см в тех местах, где преимущественно обитают моллюски - промежуточные хозяева.
Роль промежуточных хозяев Т.ocellata в средней полосе России в основном выполняют моллюски рода Lymnaea: L.auricularia, L.ovata, L.psilia psilia; L.balthica (рис. 3); в меньшей степени; L.slagnalis, L.fragilis, L.palustris; относительно редко: L.intermedia, L.monnardi, L.fontinalis, L.atra. Основное значение (с учетом распространенности, плотности популяций, общей численности в водоемах разных типов, инвазированности возбудителями шистосоматид) имеют первые 4 вида (рис. 4).
Рис. 4. Пресноводные моллюски - промежуточные хозяева шистосоматид:
1. Большой прудовик Lymnaea stagnalis;
2. Ушковидный прудовик L.auricularia;
3. Прудовик "псилия" L.psilia psilia;
4. Прудовик овальный <*> L.ovata;
5. Прудовик болотный L.palustris;
6. Роговая катушка Planorbarius comeus;
7. Катушка окаймленная Planorbis planorbis;
8. Физа Physa fontinalis.
_______________
*) Прудовик L.balthica конхологически (по раковине) сходен с L.ovata.
Чаще всего моллюски встречаются в мелководных, хорошо прогреваемых участках пойменных озер, прудов, речных заливов, стариц, отстойников, обильно заросших водной растительностью. Распределение и плотность популяций моллюсков в разных зонах водоема могут быть весьма неравномерными - от единичных до 200 - 300 экз/м2. Особенно многочисленными могут быть популяции сравнительно мелких видов моллюсков: L.ovata, L.palustris, L.balthica.
Как правило, наиболее высокой численности моллюски достигают в прибрежной полосе шириной от 1 до 10 метров (в среднем - 5 м). Именно эти мелководные участки водоемов представляют наибольшую опасность в отношении риска заражения человека церкариозами.
7.8.2. Методы исследований моллюсков
Пораженность (экстенсивность инвазии) моллюсков шистосо-матидами в водоемах не превышает 1 - 3%. Для установления истинной экстенсивности их инвазии шистосоматидами в конкретных водоемах, репрезентативная исследуемая выборка моллюсков должна составлять не менее 50 (желательно - 100) экз. каждого вида, встречающегося в водоеме. Моллюсков собирают в прибрежной полосе шириной до 5 м, с грунта или водных растений, вручную или прочным бентосным сачком.
Учитывая особенности биологии легочных моллюсков (сроки жизни, не превышающие 2 лет; период размножения, приходящийся на начало летнего периода, массовая гибель взрослых ("прошлогодних") особей в середине лета, моллюсков на наличие зараженных шистосоматидами особей в популяциях исследуют в первой трети летнего сезона. Моллюсков новой генерации ("сеголеток") исследуют в последней трети летнего и начале осеннего периода.
При исследовании живых моллюсков применяют метод прижизненной диагностики, основанный на положительном фототаксисе церкарий. Он дает наиболее достоверные результаты лишь тогда, когда партеногенетический цикл паразитов в моллюсках завершился формированием церкарий. Моллюсков поштучно рассаживают в бюксы с водой, выставляют под яркий (солнечный или искусственный) свет на 30 - 40 минут. Затем бюксы поочередно просматривают под бинокуляром МБС при увеличении х 20 - 30.
В микроаквариумах, где находятся инвазированные моллюски, хорошо заметны активно двигающиеся церкарий. При идентификации следует иметь в виду особенности морфологии церкарий. Прежде всего это касается фуркоцеркарий (с "раздвоенным хвостом"). Церкарий с длинными или короткими не раздвоенными хвостами, относящихся к трематодам других семейств, легко отличить от шистосоматид. Вместе с тем, церкарий, имеющие раздвоенный хвост, не обязательно относятся к шистосоматидам. Таким хвостом снабжены церкарий ряда семейств, не имеющих медицинского значения, например, Diplostomatidae (в основном рода Diplostomum), Strigeidae (роды: Apatemon, Cotylurus). Церкарий трематод сем. Diplostomatidae (большинство видов рода Diplostomum) отличаются по внешнему виду от церкарий шистосоматид тем, что "в свободном парении" в воде напоминают "крючки" (рис. 2). Церкарий трематод сем. Strigeidae (например, р.Apatemon) отличаются малыми размерами, длина их тела в полтора-два раза меньше церкарий шистосоматид (например, Т.ocellata), при этом длина фурок и стебля хвоста у них примерно одинаковы (рис. 2).
Для более детального исследования церкарий применяют метод компрессии гепатопанкреаса моллюсков. Тела исследуемых моллюсков (поштучно) извлекают пинцетом из раковин, раздавливают между двумя предметными стеклами и просматривают под малым увеличением (х 40 - 60) обычного светового микроскопа.
7.8.3. Разработка экспертного заключения
Обследование водоема (серии водоемов, отдельных их зон) должно завершаться экспертным заключением: "Об опасности водоема(ов) в отношении риска заражения людей церкариозами". Прежде всего это необходимо в отношении водоемов, имеющих рекреационное значение, т.е. расположенных в зонах отдыха людей и разрешенных для купания.
Для составления экспертного заключения необходима первичная информация, получаемая при комплексном обследовании водоема. Обследования проводят в середине дня при солнечной погоде (т.е., при условиях максимальной активности промежуточных хозяев и церкарий шистосоматид). Информацию по нижеприведенным показателям заносят в лабораторный журнал или компьютерную базу данных. Учитывают следующие показатели:
• 1 - географическое положение водоема и его название;
• 2 - дата проведения обследования и метеоусловия;
• 3 - тип водоема (одиночное озеро; одиночный пруд; система сообщающихся прудов или озер; участок реки; участок канала, система водоемов, образованных в результате зарегулирования русла реки; участок водохранилища; отстойник и др.);
• 4 - площадь обследуемой акватории;
• 5 - число обследованных стаций (число обследованных в водоеме прибрежных участков длиной 5 м, шириной 1 - 2 м);
• 6 - Видовой состав легочных моллюсков, обнаруженных в водоеме и собранных для лабораторных исследований с целью определения пораженности церкариями шистосоматид;
• 7 - Плотность популяций моллюсков (рассчитывается по среднему числу особей на 1 м2);
• 8 - Число моллюсков, взятых для лабораторных исследований (указывать отдельно для каждого вида моллюсков);
• 9 - Экстенсивность инвазии моллюсков шистосоматидами (число инвазированных от числа исследованных в процентах для каждого вида моллюсков);
• 10 - Степень зарастания водоема (растительности нет; зарастание слабое (менее 10 стеблей на 1 м2); зарастание умеренное и сильное (более 10 стеблей на 1 м2); наличие плавающей растительности);
• 11 - Характер фоновой растительности (учитываются: элодея, рдесты, осоки, роголистник, нимфеи, частуха, стрелолист, плавающая растительность (прежде всего - ряска), крупные макрофиты (тростник, камыш, рогоз, аир);
• 12 - Наличие в водоеме утиных птиц (прежде всего - кряквы). Указывают численность птиц на момент обследования;
• 13 - Степень загрязненности водоема (остатки пищи, остатки предметов быта, промышленные отходы, строительный мусор и др.) Водоем (его участок) загрязнен слабо: менее 3 указанных выше предметов загрязнения на 10 м прибрежной акватории шириной 3 м; водоем (его участок) загрязнен умеренно или сильно: более 3 предметов загрязнения в той же акватории;
• 14 - Использование водоема в рекреационных целях ("ДА", "НЕТ"; отдельно указывают: используется ли водоем или отдельный его участок, как официально разрешенное место для купания людей);
• 15 - Благоустроенность водоема: водоем полностью бетонирован, полностью или частично бетонирована береговая линия, производится или нет регулярная очистка от мусора и растительности, имеются или нет оснащенные пляжные территории и огороженные от остальных мест акватории для купания с песчаным грунтом без растительности, имеются или нет (на остальных береговых участках или в целом на несанкционированных для купания водоемах) знаки, запрещающие купание, подкормку птиц, свалку мусора.
На основании проведенных полевых и лабораторных исследований, составляют экспертное заключение об эпидемической опасности водоема (серии водоемов, отдельных их участков) в отношении риска заражения людей церкариозом. При этом делают вывод о том, что:
• 1 - риск заражения отсутствует (либо: нет экологических условий, благоприятных для обитания промежуточных хозяев возбудителей и нет легочных моллюсков, либо: нет источника заражения, либо: отсутствуют оба эти фактора);
• 2 - имеется потенциальный риск заражения (на исследуемой территории в принципе имеется источник инвазии (водоплавающие, прежде всего утиные, птицы) и имеются популяции промежуточных хозяев возбудителя (одного или нескольких видов легочных моллюсков). Однако на период обследования водоема в исследованной выборке моллюсков, не выявлены особи, зараженные церкариями шистосоматид);
• 3 - риск заражения присутствует (имеются популяции легочных моллюсков и в исследованной выборке обнаружены особи, зараженные шистосоматидами).
Во избежание ошибочного суждения о степени риска и, учитывая, что этот показатель изменчив в зависимости от целого ряда условий, определением "риск заражения присутствует", как правило, целесообразно ограничиться.
Когда ряд факторов со всей очевидностью указывает на высокий риск заражения в конкретных водоемах или их отдельных участках (обнаружена высокая численность популяций промежуточных хозяев, выявлена высокая пораженность моллюсков церкариями шистосоматид, имеется обильное зарастание водоема при одновременно его слабо выраженной загрязненности, водоем фактически используется для купания, особенно детьми, даже в тех случаях, когда он официально не признан рекреационной зоной), в экспертном заключении этот факт следует особо подчеркивать.
Заключение
Широкое распространение паразитарных болезней среди людей и животных способствует интенсивному обсеменению окружающей среды их возбудителями (яйца аскарид, власоглава, описторхиса, онкосферы тениид, цисты амеб, лямблий, балантидий, ооцисты криптоспоридий и др.)
Выявление возбудителей паразитозов (яйца и личинки гельминтов, цисты кишечных патогенных простейших) - наиболее точный показатель санитарно-эпидемиологического неблагополучия (фекального загрязнения) объектов окружающей среды и представляет значительный интерес для эпидемиологов и санитарных врачей. Поэтому наряду с бактериологическими, химическими, вирусологическими обязательны и санитарно-паразитологические исследования объектов окружающей среды.
Возбудителей инвазий обнаруживают в почве, воде, предметах обихода, овощах, столовой зелени (абиотическая среда), в организмах окончательных, промежуточных и дополнительных хозяев (биотическая среда).
Санитарно-паразитологический контроль за состоянием среды обитания человека является важной составной частью профилактической работы органов и учреждений здравоохранения.
Санитарно-оздоровительные и профилактические мероприятия с обеззараживанием источников инвазии и строгим лабораторным контролем за работой сооружений по подготовке питьевой воды, очистке сточных вод и животноводческих стоков, обезвреживанием нечистот, осадков сточных вод перед сбросом в поверхностные водоемы или на поля для удобрения и орошения сельскохозяйственных культур на данном этапе являются ведущими.
Лабораторные методы санитарно-паразитологических исследований являются основным и часто единственным способом установить степень риска заражения населения возбудителями гельмин-тозов и кишечных протозоозов. На основе анализа показателей степени загрузки объектов окружающей среды инвазионным материалом нечистот, динамики снижения инвазированности и заболеваемости населения и пораженности эпидемически значимых животных прогнозируется направленность изменения риска заражения и условия улучшения паразитологической ситуации как по отдельным инвазиям, так и по группам паразитозов.
Результаты лабораторных санитарно-паразитологических исследований позволяют оценивать обсемененность окружающей среды возбудителями паразитозов, риск новых заражений, прогнозировать заболеваемость населения и, на основе этого, планировать санитарные, противоэпидемические и лечебно-профилактические мероприятия, а также контролировать их эффективность.
Список литературы
1. Гигиенические требования к использованию сточных вод и их осадков для орошения и удобрения: СанПиН 2.1.7.573-96.
2. Требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества: СанПиН 2.1.4.559-96.
3. Санитарно-паразитологическое исследование воды: МУК 4.2.668-97 - М., 1997.
4. Охрана природы. Почва. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического исследования: ГОСТ 17.4.4.02-84.
5. Гигиеническая оценка качества почвы населенных мест: МУ 2.1.7.730-99.
6. Котельников Г.А. Гельминтологические исследования окружающей среды. - М.: Росагропромиздат, 1991.